Potentiëring van antikanker antilichaam werkzaamheid door Antineoplastische Drugs: detectie van antilichaam-drug synergie met de combinatie Index vergelijking
Summary
Dit protocol wordt beschreven hoe synergie tussen een antikanker antilichaam en Antineoplastische drugs in preklinische modellen met behulp van de combinatie index vergelijking van Chou en Talalay beoordelen.
Abstract
Potentiëring van vijandige monoclonal antilichamen (mAb) door chemotherapeutische agenten vormt een waardevolle strategie voor het ontwerpen van effectiever en veiliger therapie tegen kanker. Wij bieden hier een protocol ter identificatie van een rationele combinatie bij het preklinische stap. Eerst beschrijven we een cel-gebaseerde test om te beoordelen van de synergie tussen antikanker mAb en cytotoxische medicatie, die gebruikmaakt van de combinatie index vergelijking van Chou en Talalay1. Het gaat hierbij om de meting van tumor cel drugs – en antilichaam-gevoeligheid met behulp van een MTT assay, gevolgd door een analyse van de geautomatiseerde computer voor het berekenen van de waarden van de index (CI) combinatie. CI waarden van < 1 geven synergie tussen geteste mAbs en cytotoxische stoffen1. Om te bevestigen de in vitro bevindingen in vivo, beschrijven we verder een methode voor de beoordeling van de werkzaamheid regime combinatie in een xenograft tumor model. In dit model vertragingen de gecombineerde regime aanzienlijk tumorgroei, wat in een aanzienlijke langere overleving in vergelijking met single-agent besturingselementen resulteert. Nog belangrijker is, blijkt de in vivo experimenten dat de combinatie regime wordt goed verdragen. Dit protocol staat toe de doeltreffende evaluatie van antikanker drug combinaties in preklinische modellen en de identificatie van rationele combinatie in klinische proeven te evalueren.
Introduction
De conventionele aanpak in de behandeling van een groot aantal verschillende soorten kanker was gebaseerd op monotherapie. Zelfs als het nog steeds in veel gevallen gebruikt wordt, ontmoette deze methode verscheidene obstakels leidt tot kiezen voor gecombineerde therapieën2. In het bijzonder zijn de kankercellen gevoeliger voor het ontwikkelen van weerstand bij het behandeld met een enkele drug door inducerende alternatieve overleving mechanismen3, wat resulteert in therapeutisch falen in patiënten4. Bovendien, in monotherapie, drugs zijn meestal bestuurd bij een hoge dosis. Deze situatie vaak resulteert in het vóórkomen van sterke dosis-afhankelijke bijwerkingen die kunnen worden ondraaglijk en kracht van de artsen om te stoppen met de behandeling2. Om deze redenen, de vereniging van antikanker moleculen is nu de voorkeur aan monotherapie.
Ideale drug combinaties zou die in synergie tegen tumorcellen, zonder verhoogde toxiciteit tegen normale cellen handelen. Synergie verwijst naar de interactie van twee of meer drugs die produceert een therapeutisch effect groter is dan de som van elke individuele drug afzonderlijk handelen. Dergelijke interactie kunnen resulteren in betere klinische therapeutische werkzaamheid2. Het beperkt behandeling weerstand verhoogt de werkzaamheid en toxiciteit2kan ook worden verminderd. In feite, kan de dosering van elk medicijn te verlagen hun bijwerkingen door te richten verschillende routes worden verminderd. Bovendien kan een van de moleculen ook dienen als een sensibiliserende agent tegen kankercellen. Het effect van de tweede drug kan worden versterkt op gesensibiliseerde cellen en minder doseringen kunnen gebruikte5.
Gecombineerde therapie kan bevatten twee of meer chemotherapeutische geneesmiddelen en/of biologics, zoals monoclonal antilichamen6. Deze mAbs speciaal te richten op cellen uitspreken van een cel oppervlakte-antigeen van belang en zijn in staat om te doden van tumorcellen via immunologische wegen, met inbegrip van antilichaam afhankelijk cel-gemedieerde cytotoxiciteit (ADCC), met de betrokkenheid van immuun effector cellen 7, en aanvulling-afhankelijke cytotoxiciteit (CDC)6. Ze kunnen ook handelen via een niet-immunologische mechanisme gemedieerd door apoptosis8,9,10,11. In dit geval kan de inductie van het proces van geprogrammeerde celdood sensibiliseren kankercellen verzwakken van hun functie en de bijbehorende chemotherapeutische drugs doeltreffender te maken in een lagere dosering. Als zodanig, proapoptotic mAb zijn goede kandidaten voor het ontwerpen van combinatie regimes met Antineoplastische drugs.
Verschillende wiskundige modellen zijn beschreven om te beoordelen van de drug synergie; een van hen is gebaseerd op de combinatie index methode1. Deze methode is gebaseerd op het beginsel van de mediaan-effect ontwikkeld door Chou1. De mediaan-effect vergelijking correleert de dosis van de drug en drug effecten als volgt.
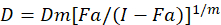
Hier, is D de dosis van het geneesmiddel; DM is de mediaan-effect dosis; FA is de breuk die beïnvloed door de dosis; m is de exponent die de vorm van de dosis / effect-perceel1betekent. De dosis van de mediaan-effect wordt gebruikt voor het berekenen van de dosis Dx van een medicament dat remt of “x” procent van cellen doodt. De CI-waarde wordt dan berekend om te beoordelen van het additieve effect van de combinatie van drugs, als volgt1.
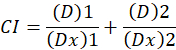
CI de waarde 1 geeft aan een additief effect en CI de waarde 1 geeft aan antagonisme1. De toepassing van deze methode wordt verder bevorderd door de beschikbaarheid van een computerprogramma, CompuSyn, die synergie en antagonisme op alle doses bepaalt of effect-niveaus gesimuleerd automatisch12.
Onze fractie heeft ontwikkeld de mAb 8B6 specifiek voor O-acetyl-GD2 ganglioside (OAcGD2) neuroblastoom antigeen13 en verder aangetoond dat deze mAb staat voor het opwekken van de dood van de cel met kenmerken van apoptosis11is. Om te testen of mAb 8B6 kunnen cellen van het neuroblastoom aan de Antineoplastische agent topotecan sensibiliseren, aangepast we de bovengenoemde methode ontwikkeld door Chou1. Eerst bepalen we de effectieve dosis 50 (ED50) waarden van mAb 8B6 en topotecan. Vervolgens de cellen van het neuroblastoom met equipotent verhoudingen van de twee verbindingen op basis van ED50 waarden zijn blootgesteld aan de CI-waarden met behulp van de bovengenoemde simulatiesoftware bepalen. Met deze methode kunt ons om aan te tonen van de synergie tussen mAb 8B6 en topotecan in vitro. Vervolgens beschrijven we een protocol voor de beoordeling van de werkzaamheid en de veiligheid van deze combinatie regime in vivo. Dit protocol kan gemakkelijk worden toegepast om te selecteren van krachtige en veilige antikanker mAb en chemotherapeutische agent combinaties in preklinische studies. Een schematische weergave van deze studie wordt gegeven in Figuur 1.
Protocol
Representative Results
Discussion
Om te voorspellen het effect van de interactie van de drug, drie methoden kunnen worden gebruikt: de isobologram methodologie17, de niet-lineaire mengsel model18en de combinatie index1. Combinatie index analyse is de meest gebruikte omdat de toepassing ervan wordt vereenvoudigd door de beschikbaarheid van een gebruiksvriendelijke computerprogramma. Voor dit doel, we eerst de dosis / effect-reactie van elke agent gebruikt alleen of in combinatie, door…
Declarações
The authors have nothing to disclose.
Acknowledgements
Steun: Fondation de Projet de L ‘Université de Nantes, les Bagouz’ à Manon, La Ligue contre le Cancer comité de Loire-Atlantique, comité du Morbihan en comité de Vendée, une roos pour S.A.R.A.H, L’Etoile de Martin en la Société Française de Lutte contre les Kanker et les leucémies de L’Enfant et de L’adolescent (SFCE). M.B. en J.F. worden ondersteund door La Ligue Contre Le Cancer. De auteurs bedanken de UTE-faciliteit van de structuur Fédérative de Recherche François Bonamy. De auteurs worden Dr. S. Suzin (Inserm, Parijs) voor het verstrekken van de IMR5 cellen en mevrouw H. Estéphan ook bedanken voor haar technische bijstand.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Pesquisa do Câncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Pesquisa do Câncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

