Antineoplastic दवाओं द्वारा विरोधी एंटीबॉडी प्रभावकारिता की Potentiation: एंटीबॉडी-ड्रग सिनर्जी संयोजन सूचकांक समीकरण का उपयोग कर का पता लगाने
Summary
इस प्रोटोकॉल का वर्णन कैसे चाऊ और Talalay के संयोजन सूचकांक समीकरण का उपयोग करके नैदानिक मॉडल में एक विरोधी एंटीबॉडी और antineoplastic दवाओं के बीच तालमेल का आकलन करने के लिए ।
Abstract
कीमोथेरेपी एजेंटों द्वारा शत्रुतापूर्ण मोनोक्लोनल एंटीबॉडी (मॉब) के Potentiation कैंसर के खिलाफ प्रभावी और सुरक्षित चिकित्सा डिजाइनिंग के लिए एक मूल्यवान रणनीति का गठन किया । यहाँ हम नैदानिक कदम पर एक तर्कसंगत संयोजन की पहचान करने के लिए एक प्रोटोकॉल प्रदान करते हैं. सबसे पहले, हम विरोधी मॉब और साइटोटोक्सिक दवाओं के बीच तालमेल का आकलन करने के लिए एक सेल-आधारित परख का वर्णन करते हैं, जो चाऊ और Talalay1के संयोजन सूचकांक समीकरण का उपयोग करता है । यह ट्यूमर सेल दवा का मापन शामिल है-और एंटीबॉडी-एक MTT परख का उपयोग कर संवेदनशीलता, संयोजन सूचकांक (CI) मूल्यों की गणना करने के लिए एक स्वचालित कंप्यूटर विश्लेषण के बाद । < 1 के CI मूल्यों का परीक्षण mAbs और साइटोटोक्सिक एजेंटों1के बीच तालमेल से संकेत मिलता है । vivo मेंइन विट्रो निष्कर्षों को पुष्ट करने के लिए, हम आगे एक xenograft ट्यूमर मॉडल में संयोजन आहार प्रभावकारिता का आकलन करने के लिए एक विधि का वर्णन । इस मॉडल में, संयुक्त आहार काफी देरी ट्यूमर विकास, जो एकल एजेंट नियंत्रण की तुलना में एक महत्वपूर्ण विस्तारित अस्तित्व में परिणाम है । महत्वपूर्ण बात, vivo प्रयोग में पता चलता है कि संयोजन आहार अच्छी तरह से सहन किया है । इस प्रोटोकॉल नैदानिक मॉडल में विरोधी दवा संयोजन के प्रभावी मूल्यांकन और तर्कसंगत संयोजन की पहचान नैदानिक परीक्षणों में मूल्यांकन करने के लिए अनुमति देता है ।
Introduction
कैंसर के विभिंन प्रकार की एक बड़ी संख्या के उपचार में पारंपरिक दृष्टिकोण मोनोथेरापी पर आधारित था । यहां तक कि अगर यह अभी भी कई मामलों में प्रयोग किया जाता है, इस विधि कई संयुक्त उपचार2के लिए चुनने के लिए अग्रणी बाधाओं से मुलाकात की । विशेष रूप से, कैंसर की कोशिकाओं को और अधिक प्रतिरोध जब वैकल्पिक जीवन रक्षा तंत्र3उत्प्रेरण द्वारा एक दवा के साथ इलाज के विकास के लिए अतिसंवेदनशील होते हैं,4रोगियों में चिकित्सीय विफलता में जिसके परिणामस्वरूप । इसके अलावा, मोनोथेरापी में, दवाओं आमतौर पर एक उच्च खुराक पर administrated हैं । यह स्थिति अक्सर प्रबल खुराक-निर्भर दुष्प्रभावों की घटना में परिणाम है कि असहनीय हो सकता है और चिकित्सकों को उपचार2को रोकने के लिए मजबूर कर सकते हैं । इन कारणों से, विरोधी अणुओं के संघ अब मोनोथेरापी को पसंद है ।
आदर्श दवा संयोजन उन है कि ट्यूमर कोशिकाओं के खिलाफ तालमेल में कार्य सामांय कोशिकाओं के खिलाफ वृद्धि की विषाक्तता के बिना, होगा । सिनर्जी दो या अधिक दवाओं है कि एक उपचारात्मक प्रत्येक व्यक्ति को अलग से अभिनय दवा के योग से अधिक प्रभाव पैदा की बातचीत को संदर्भित करता है । इस तरह की बातचीत बढ़ाकर नैदानिक चिकित्सीय प्रभावकारिता2में परिणाम हो सकता है । यह उपचार प्रतिरोध, बढ़ाता है प्रभावकारिता सीमा, और भी विषाक्तता को कम कर सकते हैं2. वास्तव में, प्रत्येक दवा की खुराक विभिन्न मार्ग को लक्षित करके उनके साइड इफेक्ट को कम करने के लिए कम किया जा सकता है. इसके अलावा, अणुओं में से एक भी कैंसर की कोशिकाओं के खिलाफ एक संवेदनशील एजेंट के रूप में सेवा कर सकते हैं । दूसरी दवा का प्रभाव संवेदनशील कोशिकाओं पर बढ़ाया जा सकता है और कम खुराकों5इस्तेमाल किया जा सकता है ।
संयुक्त चिकित्सा में दो या अधिक कीमोथेरेपी दवाओं और/या मोनोक्लोनल एंटीबॉडी के रूप में इस तरह के तर्क,6शामिल कर सकते हैं । इन mAbs विशेष रूप से लक्षित कोशिकाओं के एक सेल सतह प्रतिजन व्यक्त ब्याज की और एंटीबॉडी-निर्भर कोशिका मध्यस्थता cytotoxicity (ADCC) सहित प्रतिरक्षा रास्ते के माध्यम से ट्यूमर कोशिकाओं को मारने में सक्षम हैं, प्रतिरक्षा प्रभाव कोशिकाओं की भागीदारी के साथ 7, और पूरक-आश्रित cytotoxicity (सीडीसी)6. वे भी एक गैर प्रतिरक्षा apoptosis8,9,10,11द्वारा मध्यस्थता तंत्र के माध्यम से कार्य कर सकते हैं. इस मामले में, क्रमादेशित सेल मौत की प्रक्रिया की प्रेरण कैंसर की कोशिकाओं को संवेदनशील हो सकता है, उनके समारोह को कमजोर, और संबद्ध कीमोथेरेपी दवा एक कम खुराक पर अधिक प्रभावी बनाते हैं । जैसे, proapoptotic मॉब antineoplastic दवाओं के साथ संयोजन परहेजों डिजाइनिंग के लिए अच्छे उम्मीदवार हैं ।
विभिन्न गणितीय मॉडलों के लिए दवा के तालमेल का आकलन करने के लिए वर्णित किया गया है; उनमें से एक संयोजन अनुक्रमणिका पद्धति1पर आधारित है । इस विधि माध्य-प्रभाव चाऊ1द्वारा विकसित सिद्धांत पर आधारित है । औसत प्रभाव समीकरण इस प्रकार के रूप में दवा खुराक और दवा प्रभाव को संबद्ध ।
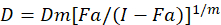
यहां, D दवा खुराक है; डीएम औसत प्रभाव खुराक है; एफए खुराक से प्रभावित अंश है; एम एक प्रतिपादक है कि खुराक प्रभाव भूखंड1के आकार का प्रतीक है । औसत प्रभाव खुराक को रोकता है कि एक दवा की खुराक Dx की गणना करने के लिए प्रयोग किया जाता है या कोशिकाओं के “एक्स” प्रतिशत को मारता है. CI मान फिर दवा संयोजन के additive प्रभाव का आकलन करने के लिए गणना की जाती है, निम्नानुसार1.
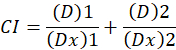
1 का ci मान एक additive प्रभाव इंगित करता है और 1 का ci मान विरोध1इंगित करता है । इस विधि के आवेदन आगे एक कंप्यूटर प्रोग्राम, CompuSyn की उपलब्धता द्वारा सुविधा है, कि सभी खुराक या प्रभाव स्तर पर सिनर्जी और विरोध निर्धारित करता है स्वचालित रूप से12अनुकरणीय.
हमारे समूह ने ओ-एसिटाइल-GD2 ganglioside (OAcGD2) neuroblastoma antigen13 के लिए विशिष्ट मॉब 8B6 विकसित किया है और आगे यह दर्शाया है कि यह मॉब11apoptosis के गुणों के साथ कोशिका मृत्यु को प्रेरित करने में सक्षम है । परीक्षण करने के लिए कि क्या मॉब 8B6 antineoplastic एजेंट topotecan करने के लिए neuroblastoma कोशिकाओं को संवेदनशील कर सकते हैं, हम चाऊ1द्वारा विकसित ऊपर उल्लेख किया विधि अनुकूलित. सबसे पहले, हम प्रभावी खुराक ५० (प्रवर्तन निदेशालय५०) मॉब 8B6 और topotecan के मूल्यों का निर्धारण । अगले, दो यौगिकों के equipotent अनुपात के साथ neuroblastoma कोशिकाओं५० मूल्यों पर आधारित के लिए सीआई मूल्यों उपर्युक्त सिमुलेशन सॉफ्टवेयर का उपयोग कर निर्धारित करने के लिए उजागर कर रहे हैं । इस विधि से हम इन विट्रो मेंमॉब 8B6 और topotecan के बीच तालमेल को प्रदर्शित करने की अनुमति देता है । अगले, हम आगे शक्ति और vivo मेंइस संयोजन आहार की सुरक्षा का आकलन करने के लिए एक प्रोटोकॉल का वर्णन । इस प्रोटोकॉल को आसानी से नैदानिक अध्ययन में शक्तिशाली और सुरक्षित विरोधी मॉब और कीमोथेरेपी एजेंट संयोजन का चयन करने के लिए लागू किया जा सकता है । इस अध्ययन के एक योजनाबद्ध प्रतिनिधित्व चित्रा 1में प्रदान की जाती है ।
Protocol
Representative Results
Discussion
दवा बातचीत के प्रभाव की भविष्यवाणी करने के लिए, तीन तरीकों का इस्तेमाल किया जा सकता है: isobologram पद्धति17, रैखिक मिश्रण मॉडल18, और संयोजन सूचकांक1. संयोजन सूचकांक विश्लेषण सबसे अधिक ?…
Declarações
The authors have nothing to disclose.
Acknowledgements
ग्रांट सपोर्ट: शौकीन्स डे Projet डे L’Université डे नांत, लेस Bagouz ‘ à Manon, La Ligue contre le Cancer comité डे लॉयर-Atlantique, comité डु Morbihan, आणि comité डे गाहक, उणे रोज नमुने एस. ए. आर ए. ज, L’Etoile डे मार्टिन एंड ला Société फ़्रांसेज़ डे लट्टी contre लेस कैंसर एट लेस leucémies डे L’Enfant एट डे L’adolescent (SFCE) । M.B. और J.F. ला Ligue Contre Le Cancer द्वारा समर्थित हैं । लेखकों ने ूते-सुविधा की संरचना Fédérative de सभ्य फ़्रांस्वा Bonamy का शुक्रिया अदा किया । लेखकों ने डॉ॰ एस Suzin (Inserm, पेरिस) को IMR5 कोशिकाएं प्रदान करने के लिए और उसे तकनीकी सहायता के लिए सुश्री एच. Estéphan का भी धन्यवाद दिया ।
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Pesquisa do Câncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Pesquisa do Câncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

