抗がん剤抗体抗悪性腫瘍薬による効果の増強: 組み合わせインデックス式を用いた抗体医薬の相乗作用の検出
Summary
このプロトコルでは、シュー クリームと Talalay 組み合わせインデックス式を使用して抗がん剤抗体と前臨床モデルで抗悪性腫瘍薬の間の相乗作用を評価する方法について説明します。
Abstract
敵対的なモノクローナル抗体 (mAb) による化学療法剤の増強効果は、がんに対して効果的で安全な治療を設計するための重要な戦略を構成します。ここでは、前臨床段階で合理的な組み合わせを識別するプロトコルを提供します。まず、Talalay ・周1の組み合わせのインデックス式を使用する抗癌剤 mAb と細胞毒性薬物の相乗効果を評価するために細胞に基づく試金を記述します。これは測定の腫瘍細胞と抗体-感受性インデックス (CI) 値の組み合わせを計算するコンピューターが自動的に分析に続いて、MTT アッセイを使用して含まれています。CI の値 < 1 テスト Mab と細胞毒性薬1間の相乗作用を示します。体外の調査結果、体内を裏付ける、さらに異種移植腫瘍モデルの組み合わせ療法の有効性を評価する方法を説明します。このモデルでは、併用療法が腫瘍の成長は、単剤コントロールと比較して有意な拡張生存の結果大幅に遅れます。重要なは、生体内で実験は併用療法は忍容性を明らかにします。このプロトコルには、前臨床モデルで抗癌性の薬剤の組み合わせの有効性評価と臨床試験を評価する合理的な組み合わせの同定ができます。
Introduction
癌のさまざまな種類の多数の治療に従来のアプローチは、単独療法に基づいていた。場合でも、それは多くの場合使用このメソッドは複合療法2を選ぶことにつながるいくつかの障害に会った。特に、がん細胞が耐性を代替生存メカニズム3患者4の治療の失敗の結果を誘導することによって単一の薬剤と扱われたときになりやすい。また、単独療法、薬、高用量で投与は通常。多くの場合このような状況は我慢でき治療2を停止するために医師を強制的に強力な用量依存性副作用の発生の結果します。これらの理由から、抗癌剤分子の協会は今単独投与することが好ましい。
理想的な薬の組み合わせは、正常細胞に対して毒性を増加することがなく、腫瘍細胞に対する相乗効果で作用するでしょう。相乗効果は、それぞれ個々 の薬剤別に演技の合計よりも大きい治療効果を生成する 2 つ以上の薬剤の相互作用を指します。このような相互作用が臨床治療効果2にあります。治療抵抗性を制限、効果をアップ、また毒性2を減らすことができます。実際には、その副作用を下げる様々 な経路をターゲットに各薬剤の投与量を削減できます。さらに、分子の 1 つはまた癌細胞に対する増感剤として使用できます。感作細胞に関する 2 番目の薬の効果を高めることができるし、少ない用量で使用される5をすることができます。
併用療法は、2 つ以上の化学療法薬および/または6モノクローナル抗体などの生物製剤を含めることができます。これらの Mab の関心とは抗体依存性細胞媒介性細胞傷害 (ADCC) を含む免疫学的経路を介して腫瘍細胞を殺すことができる細胞の表面抗原を発現する細胞を標的免疫エフェクター細胞の関与7、および補体依存性細胞傷害 (CDC)6。彼らは、を介してアポトーシス8,9,10,11を介した非免疫機構も機能できます。この場合、プログラム細胞死のプロセスの誘導が癌細胞に感光性、彼らの機能を弱める、関連付けられている化学療法薬を低用量でより効果的に。そのため、アポトーシスの mAb が抗がん剤のレジメンを設計するため適しています。
別の数学的モデルは、薬剤の相乗効果の評価に記載されています。それらの 1 つは、組み合わせのインデックス方法1に基づいています。シュー クリーム1によって開発された中央効果原理に基づくです。中央効果方程式は、次のとおり薬剤の投与量と薬の効果を関連付けます。
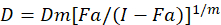
ここで、 Dは薬物投与です。Dmは中央効果線量;Fa ; 線量によって影響を受ける割合は、します。mは、線量効果プロット1の形状を示す指数です。中央効果用量を使用して、 Dxを阻害するあるいはセルの”x“% を殺す薬剤の投与量を計算します。CI 値が1を次のように、薬の組み合わせの添加剤の効果を評価するために計算されます。
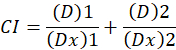
1 の低 CI 値を示し、添加剤の効果の低 CI 値 1 拮抗作用1を示します。このメソッドのアプリケーションはさらに相乗効果と全ての用量で対立を決定する CompuSyn、コンピューター プログラムの可用性によって促進されるまたは効果のレベルは自動的にシミュレートされた12。
当社グループ O アセチル GD2 ガングリオシド (OAcGD2) 神経芽細胞腫抗原13 mAb 8B6 特定を開発し、さらにこの mAb がアポトーシス11の属性と細胞死を誘導することができることを示した。MAb 8B6 神経芽細胞腫細胞抗悪性腫瘍剤トポテカン感光性を与えることができるかどうかをテストするため、我々 は周1によって開発された上記の方法を適応しました。まず、mAb 8B6 とトポテカンの実効線量 50 (ED50) 値を決定します。次に、ED50値に基づいて 2 つの化合物の等効力比を持つ神経芽細胞腫細胞は、上記のシミュレーション ソフトを用いた CI 値を決定する公開されます。このメソッドは mAb 8B6 とトポテカンの併用体外間の相乗作用を実証することができます。次に、さらに効力とこの組み合わせ療法生体内での安全性を評価するためのプロトコルについて述べる。このプロトコルは、前臨床試験において強力かつ安全な抗がん剤 mAb との化学療法のエージェントの組み合わせを選択する簡単に適用できます。本研究の概略は、図 1で提供しています。
Protocol
Representative Results
Discussion
薬物相互作用の効果を予測する 3 つの方法を使用できます: isobologram 方法論17、非線形混合モデル18、および組み合わせインデックス1。インデックス分析の組み合わせは、ユーザーフレンドリーなコンピューター プログラムの可用性でそのアプリケーションを簡略化するために最もよく使用されます。この目的のため我々 は最初 MTT の試?…
Declarações
The authors have nothing to disclose.
Acknowledgements
サポートを付与: 財団・ デ ・挙デ L ‘ユニヴェルシテ ・ ド ・ ナント、レ Bagouz’ à La Ligue contre le がん comité マノン ・ ド ・ ロワール = アトランティック県、comité デュ モルビアンと comité ・ ド ・ ヴァンデの宇根バラを注ぐ S.A.R.A.H、エトワール ・ ド ・ マーティンとソシエテ ・ フランセーズ ・ デ ・ ルッテ contre レ ラ癌エ レ leucémies デ ランファン et ・ デ ・ L’adolescent (SFCE)。および j. f. は、La Ligue Contre Le がんによってサポートされます。著者は、構造 Fédérative ・ フランスのフランソワ ・ Bonamy の UTE 施設をありがとうございます。著者は、IMR5 セルを提供するための博士 s. Suzin (Inserm、パリ) とさん h. Estéphan を彼女のテクニカル サポートにもありがとうございます。
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Pesquisa do Câncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Pesquisa do Câncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

