Potensiering av Anticancer antistoff effekten av Antineoplastic legemidler: påvisning av antistoff-stoff Synergism ved hjelp av kombinasjon Index formelen
Summary
Denne protokollen beskriver hvordan å vurdere synergism mellom et anticancer antistoff og antineoplastic legemidler i preklinisk modeller ved hjelp av kombinasjon indeks ligning Chou og Talalay.
Abstract
Potensiering av fiendtlige monoklonale antistoffer (mAb) av chemotherapeutic agenter utgjør en verdifull strategi for å utforme effektive og tryggere behandling mot kreft. Her gir vi en protokoll for å identifisere en rasjonell kombinasjon ved prekliniske trinn. Først beskrive vi et cellebasert analysen for å vurdere synergism mellom anticancer mAb og cytotoksiske medikamenter, som bruker kombinasjon indeks ligningen Chou og Talalay1. Dette inkluderer måling av svulst celle narkotika og antistoff-følsomhet ved hjelp av en MTT-analysen, etterfulgt av en automatisert datamaskinen analyse til å beregne de kombinasjon-indeksverdiene (CI). CI verdier for < 1 indikerer synergism mellom testet mAbs og cytotoksiske agenter1. For å bekrefte den i vitro funn i vivo, beskriver vi videre en metode for å vurdere kombinasjon diett effekten i en xenograft svulst modell. I denne modellen forsinker den kombinerte diett vesentlig tumor vekst, som resulterer i en betydelig utvidet overlevelse i forhold til single-agent kontroller. Viktigere, avslører i vivo eksperimentering at kombinasjonen diett er godt tolerert. Denne protokollen gir effektiv evalueringen av anticancer rusmiddelkombinasjoner i preklinisk modeller og identifikasjon av rasjonell kombinasjon å vurdere i kliniske forsøk.
Introduction
Konvensjonelle tilnærming i behandlingen av en rekke ulike typer kreft var basert på monoterapi. Selv om det er fortsatt brukt i mange tilfeller, møtte denne metoden flere hindringer fører til optisk for kombinert terapier2. Kreftceller er spesielt mer utsatt for å utvikle resistens når behandlet med et enkelt stoff av inducing alternativ overlevelse mekanismer3, som resulterer i terapeutisk feil i pasienter4. Videre i monoterapi, er narkotika vanligvis administreres på en høy dose. Denne situasjonen ofte resulterer i forekomsten av sterk doseavhengig bivirkninger som kan være utålelig og tvinge leger å stoppe behandling2. For disse grunner, association of anticancer molekyler er nå foretrukket å monoterapi.
Ideell rusmiddelkombinasjoner vil være de som fungere i synergi mot kreftceller, uten økt toksisitet mot normale celler. Synergism refererer til interaksjon av to eller flere stoffer som produserer en terapeutisk effekt som er større enn summen av enkelte rusmiddel handle separat. Slike interaksjoner kan føre til forbedret klinisk terapeutisk effekt2. Det begrenser behandling motstand øker effekten og kan også redusere toksisitet2. Faktisk reduseres dosen av hvert legemiddel for å redusere sine bivirkninger av målretting ulike veier. I tillegg kan en av molekyler også tjene som en sensibiliserende agent mot kreftceller. Effekten av stoffet på andreplass kan bli styrket på sensitivisert celler og færre doser kan være brukt5.
Kombinert behandling kan inneholde to eller flere cellegifter og/eller biologiske, for eksempel monoklonale antistoffer6. Disse mAbs spesifikt mål celler som uttrykker en celle-overflate antigen av interesse og er kjøpedyktig drepe kreftceller gjennom immunologiske trasé inkludert antistoff-avhengig celle-mediert cytotoksisitet (ADCC), med involvering av immun Effektor celler 7og komplement-avhengige cytotoksisitet (CDC)6. De kan også fungere via en ikke-immunologiske mekanisme formidlet av apoptose8,9,10,11. I dette tilfellet kan induksjon av prosessen med programmert celledød sensitize kreftceller, svekke deres funksjon og gjøre tilknyttede chemotherapeutic stoffet mer effektiv med en lavere dose. Slik proapoptotic mAb er gode kandidater for utforming kombinasjon regimer med antineoplastic stoffer.
Ulike matematiske modeller har blitt beskrevet for å vurdere narkotika synergism; en av dem er basert på kombinasjonen indeks metode1. Denne metoden er basert på median-effekt prinsippet utviklet av Chou1. Median-effekt ligningen korrelerer narkotika dose og narkotika effekt som følger.
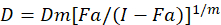
Her er D narkotika dosen; DM er median-effekt dosen; FA er en brøkdel av dosen; m er en eksponent som angir formen av dose-effekten plot1. Median-effekt dosen brukes til å beregne dosen Dx av et stoff som hemmer eller dreper “x” prosent av cellene. CI verdien beregnes for å vurdere den additiv effekten av legemidlet kombinasjonen, slik1.
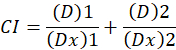
CI verdien 1 indikerer en additiv effekt og CI verdien 1 angir antagonisme1. Anvendelsen av denne metoden er mer tilrettelagt av tilgjengeligheten av et dataprogram, CompuSyn, som bestemmer synergism og antagonisme på alle doser eller effekt nivåer simulert automatisk12.
Vår gruppe har utviklet den mAb 8B6 spesifikt for O-acetyl-GD2 ganglioside (OAcGD2) neuroblastom antigen13 og videre demonstrerte at denne mAb er kjøpedyktig indusere celledød med attributter av apoptose11. For å teste om mAb 8B6 kan sensitize neuroblastom celler antineoplastic agent topotecan, tilpasset vi de ovenfor nevnte metoden utviklet av Chou1. Først fastslår vi effektive dose 50 (ED50) verdiene i mAb 8B6 og topotecan. Neste, neuroblastom cellene med equipotent prosenter av to forbindelser basert på ED50 verdier er utsatt for å bestemme CI verdiene med ovennevnte simuleringsprogram. Denne metoden tillater oss å demonstrere synergism mellom mAb 8B6 og topotecan i vitro. Deretter beskriver vi en protokoll for å vurdere videre styrken og sikkerheten til denne kombinasjonen diett i vivo. Denne protokollen kan lett brukes for å velge potent og trygt anticancer mAb og chemotherapeutic agent kombinasjoner i preklinisk studier. En skjematisk fremstilling av denne studien finnes i figur 1.
Protocol
Representative Results
Discussion
Tre metoder kan brukes for å forutsi effekten av interaksjoner,: de isobologram metodikk17og ikke-lineære blanding modell18kombinasjonen indeksere1. Kombinasjon indeks analyse er mest vanlig fordi programmet er forenklet av tilgjengeligheten av et brukervennlig program. For dette formålet preget vi først dose-effekt svar hver agent brukes alene eller i kombinasjon, ved å utføre en MTT analysen19. Denne metoden bruker på…
Declarações
The authors have nothing to disclose.
Acknowledgements
Gi støtte: Fondation de Projet de L ‘Université de Nantes, les Bagouz’ à Manon, La Ligue contre le kreft comité de Loire-Atlantique, comité du Morbihan, og comité de Vendée, une steg hell S.A.R.A.H, L’Etoile de Martin og la Société Française de Lutte contre les Kreft et les leucémies de L’Enfant et de L’adolescent (SFCE). MB og J.F. støttes av La Ligue Contre Le kreft. Forfatterne takker UTE-anlegget på struktur Fédérative de Recherche François Bonamy. Forfatterne også takke Dr. S. Suzin (Inserm, Paris) for å gi IMR5 cellene og Ms. H. Estéphan for hennes kundestøtte.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Pesquisa do Câncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Pesquisa do Câncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

