Antikanser antikor etkinliğinin Antineoplastic uyuşturucu tarafından kullanılmasının muhtemelen: antikor-uyuşturucu Synergism kombinasyon Dizin denklem kullanılarak tespiti
Summary
Bu iletişim kuralı, antikanser bir antikor ve antineoplastic ilaçlar içinde Preklinik modelleri arasında synergism Chou ve Talalay birlikte Dizin denklemi kullanarak değerlendirmek açıklar.
Abstract
Düşman monoklonal antikor (mAb) kemoterapötik ajanlar tarafından kullanılmasının muhtemelen kansere karşı etkili ve daha güvenli tedavi tasarlamak için değerli bir strateji kabul ettiğiniz anlamına gelir. Burada preklinik adım da rasyonel bir arada tanımlamak için bir protokol sağlar. İlk olarak, Chou ve Talalay1kombinasyonu Dizin denklemi kullanır synergism antikanser mAb ve sitotoksik ilaçlar arasında değerlendirmek için bir hücre tabanlı tahlil açıklar. Bu ölçüm, tümör hücre uyuşturucu ve antikor-kombinasyon dizin (CI) değerlerini hesaplamak için bir otomatik bilgisayar Analizi tarafından takip bir ÇMT tahlil kullanarak duyarlılığı içerir. CI değerlerini < 1 belirtmek synergism test mAbs ve sitotoksik ajanlar1arasında. Vitro bulgular vivoteyit için daha fazla kombinasyon rejimi etkinliğini xenograft tümör modelindeki değerlendirmek için bir yöntem açıklar. Bu modelde, kombine rejimi önemli ölçüde önemli bir genişletilmiş hayatta kalma tek ajan denetimleri ile karşılaştırıldığında sonuç tümör büyüme geciktirir. Önemlisi, in vivo deneyler kombinasyon rejimi iyi tolere edilir ortaya koymaktadır. Bu iletişim kuralı preklinik modelleri kombinasyonlarda antikanser ilaç etkili değerlendirilmesi ve klinik deneylere değerlendirmek için rasyonel birleşimini tanımlaması sağlar.
Introduction
Çok sayıda farklı kanser tedavisinde geleneksel yaklaşım üzerinde tedavinin dayanıyordu. Hala birçok durumda kullanılır olsa bile, bu yöntem kombine tedaviler2için gözle ilgili için önde gelen çeşitli engeller tanıştım. Özellikle, kanser hücrelerinin alternatif hayatta kalma mekanizmaları3hastalar4terapötik başarısızlıkla sonuçlanan, inducing tarafından tek bir ilaç ile tedavi ederken direnç geliştirmek daha yatkındır. Ayrıca, tedavinin içinde uyuşturucu genellikle yüksek bir doz idare. Bu durum genellikle dayanılmaz ve doktorlar tedavi2durdurmak için kuvvet güçlü doz bağımlı yan etkileri oluşumu içinde sonuçlanır. Bu nedenlerden dolayı antikanser molekülleri şimdi birliğidir tedavinin için tercih etti.
İdeal uyuşturucu kombinasyonları Bu sinerji tümör hücreleri, normal hücrelere karşı artan toksisite olmadan karşı hareket olacaktır. Synergism tedavi edici etkiye ayrı ayrı hareket her bireysel uyuşturucu toplamından daha büyük üreten iki veya daha fazla ilaç etkileşimi gösterir. Bu tür etkileşimler geliştirilmiş klinik tedavi etkinliğinin2‘ de neden olabilir. Tedavi direnci sınırlar, etkinliğini artırır ve ayrıca toksisite2azaltabilir. Aslında, her ilaç dozu farklı yollar hedefleyerek yan etkileri azaltmak için azaltılabilir. Buna ek olarak, bir moleküller de kanser hücrelerinin karşı duyarlılığı bir ajan olarak hizmet edebilir. İkinci ilacın etkisi duyarlilasmis hücreleri üzerinde gelişmiş ve daha az dozlarda kullanılan5olabilir.
Kombine tedavi iki veya daha fazla kemoterapötik ilaçlar ve/veya monoklonal antikorlar6gibi destekte içerebilir. Bu mAbs özellikle faiz ve immünolojik yollar dahil antikor bağımlı sitotoksisite (CCDA), hücre-aracılı ile tümör hücreleri öldürmek mümkün olan bir hücre yüzey antijeni ifade hücreleri hedef hücreleri bağışıklık efektör katılımı ile 7ve tamamlayıcı bağımlı sitotoksisite (CDC)6. Onlar da üzerinden apoptosis8,9,10,11tarafından aracılı immünolojik olmayan bir mekanizma hareket edebilir. Bu durumda, indüksiyon işleminin programlı hücre ölümü kanser hücrelerinin duyarlı, işlevlerine zayıflatmak ve ilişkili kemoterapötik ilaç daha düşük bir doz daha verimli hale getirmek. Bu nedenle, proapoptotic mAb kombinasyonu rejimlerinin antineoplastic ilaçlarla tasarlamak için iyi adaylar bulunmaktadır.
Uyuşturucu synergism değerlendirmek için farklı matematiksel modeller tarif var; Bunlardan biri üzerinde birlikte Dizin Yöntem1temel alır. Bu yöntem Chou1tarafından geliştirilen medyan-etkisi ilkesine dayanır. Medyan-etkisi denklem uyuşturucu doz ve uyuşturucu etkisi aşağıdaki gibi karşılıklı olarak ilişkilendirir.
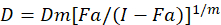
D ilaç doz işte; DM medyan-etkisi doz ise; SK doz tarafından etkilenen kesir olduğunu; m 1doz-etki arsa şeklini belirten bir üstür. Medyan-etkisi doz doz Dx engeller ya da “x” yüzde hücre öldürür bir ilacın hesaplamak için kullanılır. CI değer o zaman1aşağıdaki gibi uyuşturucu kombinasyon katkı etkisini değerlendirmek için hesaplanır.
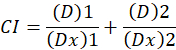
Bir katkı etkisi ve CI değeri 1 CI değeri gösterir 1 husumet1gösterir. Bu yöntemin uygulama daha fazla bir bilgisayar programı, CompuSyn, synergism ve düşmanlık tüm dozda belirleyen kullanılabilirliğini tarafından yönetilir veya etkisi düzeylerini otomatik olarak12simüle.
Bizim grup mAb 8B6 özel O-asetil-GD2 gangliosid (OAcGD2) Nöroblastom antijen13 için geliştirilmiş ve daha fazla bu mAb hücre ölümü apoptozis11özniteliklerle ikna etmek mümkün olduğunu gösterdi. MAb 8B6 antineoplastic Ajan topotecan hücrelere Nöroblastom duyarlı olup olmadığını sınamak için yukarıda belirtilen yöntem Chou1tarafından geliştirilen uyarlanmış. İlk olarak, mAb 8B6 ve topotecan etkili doz 50 (ED50) değerlerini belirleriz. Daha sonra equipotent oranları ED50 değerlere göre iki bileşiklerin Nöroblastom hücrelerle yukarıda belirtilen simülasyon yazılımı kullanarak CI değerlerini belirlemek için sunulur. Bu yöntem synergism mAb 8B6 ve topotecan içinde vitroarasında göstermek için bize izin verir. Sonra biz daha fazla etki gücüne ve bu kombinasyon rejimi içinde vivogüvenliğini değerlendirmek için bir protokol tanımlamak. Bu iletişim kuralı, güçlü ve güvenli antikanser mAb ve kemoterapötik ajan kombinasyonuna preklinik çalışmalarda seçmek için kolayca uygulanabilir. Bu çalışmada şematik gösterimi Şekil 1‘ de verilmiştir.
Protocol
Representative Results
Discussion
İlaç etkileşimleri etkisini tahmin etmek için üç yöntem kullanılabilir:1isobologram metodoloji17, doğrusal olmayan karışımı modeli18ve kasanın içindekiler. Uygulama kullanıcı dostu bilgisayar programı kullanılabilirlik tarafından Basitleştirilmiş kombinasyonu Dizin analiz en sık kullanılır. Bu amaçla, ilk doz-etki tepki bir ÇMT tahlil19gerçekleştirerek tek başına veya birlikte, kullanılan her ar…
Declarações
The authors have nothing to disclose.
Acknowledgements
Hibe desteği: Fondation de projesi de L ‘Université de Nantes, les Bagouz’ à Manon, La Ligue contre le kanser Comite de Loire-Atlantique, comité du Morbihan ve Comite de Vendée, une gül dökün S.A.R.A.H, L’Etoile de Martin ve la Société Française de Lutte contre les Kanser et les leucémies de L’Enfant et de L’adolescent (SFCE). M.B. ve J.F. La Ligue Contre Le kanser tarafından desteklenir. Yazarlar UTE tesisin yapısı Fédérative de Recherche François Bonamy, teşekkür ederim. Yazarlar onun teknik yardım almak için Ayrıca Dr. S. IMR5 hücreler sağlamak için Suzin (INSERM, Paris) ve Bayan H. Estéphan teşekkür ederiz.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referências
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Pesquisa do Câncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Pesquisa do Câncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

