Induktion und Charakterisierung der pulmonalen Hypertonie bei Mäusen mit dem Hypoxia/SU5416-Modell
Summary
Dieses Protokoll beschreibt die Induktion von pulmonaler Hypertonie (PH) bei Mäusen basierend auf der Exposition gegenüber Hypoxie und der Injektion eines VEGF-Rezeptor-Antagonisten. Die Tiere entwickeln 3 Wochen nach Beginn des Protokolls eine PH- und rechtsventrikuläre (RV) Hypertrophie. Die funktionale und morphometrische Charakterisierung des Modells wird ebenfalls dargestellt.
Abstract
Pulmonale Hypertonie (PH) ist ein pathophysiologischer Zustand, definiert durch einen mittleren pulmonalen arteriellen Druck von mehr als 25 mm Hg im Ruhezustand, wie durch rechte Herzkatheterisierung beurteilt. Ein breites Spektrum von Krankheiten kann zu PH führen, unterschiedlich in ihrer Ätiologie, Histopathologie, klinische Präsentation, Prognose, und Reaktion auf die Behandlung. Trotz erheblicher Fortschritte in den letzten Jahren bleibt PH eine unheilehafte Krankheit. Das Verständnis der zugrunde liegenden Mechanismen kann den Weg für die Entwicklung neuer Therapien ebnen. Tiermodelle sind wichtige Forschungsinstrumente, um dieses Ziel zu erreichen. Derzeit stehen mehrere Modelle zur Rekapitulation von PH zur Verfügung. Dieses Protokoll beschreibt ein PH-Modell mit zwei Treffern. Die Reize für die PH-Entwicklung sind Hypoxie und die Injektion von SU5416, einem vaskulären endotheliaalen Wachstumsfaktor (VEGF)-Rezeptor-Antagonisten. Drei Wochen nach Beginn von Hypoxie/SU5416 entwickeln Tiere eine pulmonale Gefäßumgestaltung, die die histopathologischen Veränderungen imitiert, die bei humanem PH beobachtet wurden (überwiegend Gruppe 1). Die vaskuläre Umgestaltung im Lungenkreislauf führt zur Umgestaltung der rechten Herzkammer (RV). Die Verfahren zur Messung von RV-Drücken (mit Hilfe der Methode der offenen Brust), die morphometrischen Analysen des RV (durch Sezieren und Wiegen beider Herzkammern) und die histologischen Beurteilungen des Umbaus (sowohl pulmonale durch Diekonversion als auch Herz durch Beurteilung der RV-Kardiomyozytenhypertrophie und Fibrose) werden ausführlich beschrieben. Die Vorteile dieses Protokolls sind die Möglichkeit der Anwendung sowohl bei Wildarten als auch bei gentechnisch veränderten Mäusen, die relativ einfache und kostengünstige Umsetzung und die schnelle Entwicklung der Krankheit von Interesse (3 Wochen). Einschränkungen dieser Methode sind, dass Mäuse keinen schweren Phänotyp entwickeln und PH bei Rückkehr zu Normoxia reversibel ist. Prävention, sowie Therapiestudien, können leicht in diesem Modell implementiert werden, ohne die Notwendigkeit von fortgeschrittenen Fähigkeiten (im Gegensatz zu chirurgischen Nagetiermodellen).
Introduction
Pulmonale Hypertonie (PH) ist eine pathophysiologische Erkrankung, definiert durch einen mittleren pulmonalen arteriellen Druck (PA) von mehr als 25 mm Hg im Ruhezustand, wie durch rechte Herzkatheterisierung1,2beurteilt. Es gibt eine Vielzahl von Krankheiten, die zu PH führen können. Um die PH-assoziierten Bedingungen zu organisieren, wurden mehrere Klassifikationssysteme entwickelt. Die aktuelle klinische Klassifikation kategorisiert die multiplen PH-assoziierten Krankheiten in 5 verschiedene Gruppen1. Diese Unterscheidung ist von Bedeutung, da verschiedene Gruppen von Patienten Krankheiten haben, die sich in ihrer klinischen Darstellung, Pathologie, Prognose und Reaktion auf Behandlung unterscheiden2. Tabelle 1 fasst die aktuelle Klassifikation zusammen, ergänzt durch die grundlegenden histopathologischen Merkmale jeder Krankheit.
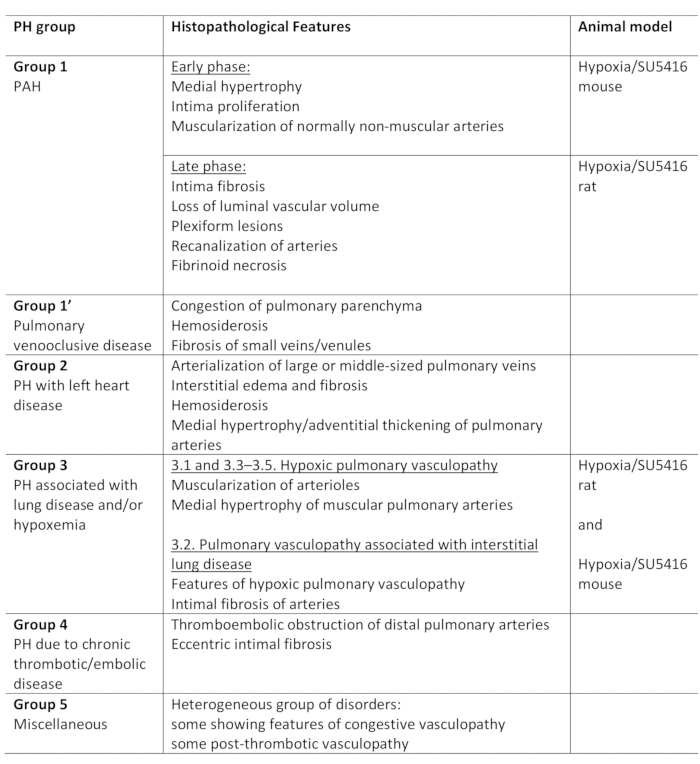
Tabelle 1: Überblick über die klinische Klassifikation von PH, zusammen mit den wichtigsten histopathologischen Merkmalen innerhalb der Gruppen. Eignung des Protokolls Hypoxia/SU5416 zur Modellierung von PH. Diese Tabelle wurde von19geändert. PH: Pulmonale Hypertonie, PAH: Pulmonale arterielle Hypertonie
Trotz erheblicher Fortschritte bei der Behandlung von PH-assoziierten Krankheiten bleibt PH ohne Heilung, mit einer 3-Jahres-Sterblichkeitsrate zwischen 20% und 80%3. Dies zeigt die zwingende Notwendigkeit, die zugrunde liegenden Mechanismen von PH und danach die Entwicklung neuer Therapien zu verstehen, um das Fortschreiten zu verhindern, zu verlangsamen und die Krankheit zu heilen. Tiermodelle sind für diesen Bereich von entscheidender Bedeutung. Derzeit gibt es verschiedene Modelle, um PH zu studieren. Der interessierte Leser wird auf die ausgezeichneten Rezensionen zu diesem Thema2,3,4verwiesen. Angesichts der Vielzahl von Krankheiten, die zu PH führen, ist es offensichtlich, dass die vielfältigen Bedingungen des menschlichen PH nicht in einem Tiermodell perfekt rekapituliert werden können. Die verfügbaren Tiermodelle können in i) Single-Hit, ii) Two-Hit, iii) Knockout und iv) Overexpression-Modelle3kategorisiert werden. In den Single-Hit-Modellen wird PH durch einen einzigen pathologischen Reiz induziert, während Zwei-Treffer-Modelle zwei pathologische Reize mit dem Ziel kombinieren, schwerere PH zu induzieren und damit die komplexe menschliche Krankheit genauer nachzuahmern. Neben den ätiologischen Unterschieden führen die verschiedenen Reize zu PH-Modellierungsunterschieden, die auch von der Art und dem genetischen Hintergrund der Tiere abhängen4.
Eines der am häufigsten verwendeten klassischen PH Nagetiermodelle ist die chronische Hypoxie Modell2. Hypoxie ist bekannt, PH beim Menschen sowie bei mehreren Tierarten induzieren. Hypoxie hat den Vorteil, ein physiologischer Stimulus für PH zu sein (Tabelle 1). Während jedoch der Grad der Hypoxie, der zur Induktion von PH bei Nagetieren verwendet wird, viel schwerer ist als beim Menschen, führt die einzelne Beleidigung (Hypoxie) nur zu einer milden Form der vaskulären Umgestaltung. Dies imitiert nicht die Schwere der menschlichen Krankheit. Die Zugabe eines Zweiten Treffers, ein zusätzlicher Stimulus zur Induktion von PH, zeigte vielversprechende Ergebnisse: Die Injektion der Verbindung SU5416 an Nagetiere in Kombination mit dem hypoxischen Stimulus induziert einen schwereren PH-Phänotyp2,5,6. SU5416 ist ein Inhibitor des vaskulären endotheliaalen Wachstumsfaktors (VEGF)-Rezeptor-2. Es blockiert die VEGF-Rezeptoren und führt zu Endothelzellapoptose. Unter hypoxischen Bedingungen stimuliert dies die Proliferation einer Teilmenge apoptoseresistenter Endothelzellen. Darüber hinaus führt SU5416 zu einer reibungslosen Zellproliferation der Muskelzellen. Die Kombination dieser Effekte führt zu einer pathologischen vaskulären Umgestaltung des Lungenkreislaufs und führt zu erhöhtem PA-Druck und rechtsventrikulärer Umgestaltung2,5,7. Das Modell wurde zuerst in Ratten6 beschrieben und später auf Mäuse4,5,7angewendet. Das Mausmodell weist im Vergleich zu Ratten eine weniger schwere Gefäßumgestaltung auf. Darüber hinaus, wenn zu Normoxia zurück, PH weiterhin Fortschritte bei Ratten, während bei Mäusen ist es teilweise reversibel.
Das folgende Protokoll beschreibt alle Schritte zur Modellierung von PH bei Mäusen mit der Hypoxia/SU5416-Methode (Planung, Zeitleiste, Ausführung). Zusätzlich wird die Charakterisierung des Modells in diesem Protokoll beschrieben: funktionell (durch invasive Messung des rechten ventrikulären (RV) Drucks mit der offenen Brusttechnik), morphometrisch (durch Sezieren und Wiegen sowohl der rechten und linken Ventrikel als auch histologisch (durch Bewertung des pulmonalen VaskulärenRekonsedes, rechtsventrikulärer Kardiomyozytenhypertrophie und Fibrose).
Alle in diesem Protokoll beschriebenen Schritte und Methoden können von den Ermittlern auf jeder Erfahrungsebene einfach implementiert werden. Während die funktionellen Messungen des Wohnmobils mit der offenen Brusttechnik (hier beschrieben) nicht die Goldstandardmethode auf dem Gebiet sind, hat es den Vorteil, dass es auch von einem weniger erfahrenen Experimentator schnell erlernt und genau reproduziert werden kann.
Protocol
Representative Results
Discussion
Dieses Protokoll beschreibt, wie man PH bei Mäusen modellieren kann, indem man zwei pathologische Reize kombiniert: chronische Hypoxie und SU5416-Injektion (Hypoxie/SU5416)18. Um dieses Mausmodell mit der menschlichen PH-Bedingung zu korrelieren, muss man sich unweigerlich die aktuelle PH-Klassifikation ansehen, die in Tabelle 1dargestellt ist. PH in fast allen Formen ist durch pulmonale Vasokonstriktion und abnorme Proliferation von endothelialen und glatten Muskelzellen gekennz…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch Stipendien der American Heart Association (AHA- 17SDG33370112 und 18IPA34170258) und der National Institutes of Health NIH K01 HL135474 an Y.S. O.B. unterstützt.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
Referências
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

