Kwantificering van drie DNA-laesies door massaspectrometrie en beoordeling van de niveaus in weefsels van muizen die worden blootgesteld aan omgevings fijne deeltjes
Summary
We beschrijven hier methoden voor gevoelige en accurate kwantificering van de laesies 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodGuo), 1, n6-etheno-2′-deoxyadenosine (1, n6-dAdo) en 1,n2– etheno-2′-deoxyguanosine (1,N2-dGuo) in DNA. De methoden werden toegepast op de beoordeling van de effecten van de omgevings fijn stof (PM2,5) in weefsels (Long, lever en nier) van blootgestelde A/J muizen.
Abstract
DNA-adducten en geoxideerde DNA-bases zijn voorbeelden van DNA-laesies die nuttig zijn biomarkers voor de toxiciteit beoordeling van stoffen die zijn elektrofiele, het genereren van reactieve elektrofielen op biotransformatie, of induceren oxidatieve stress. Onder de geoxideerde nucleobasen, de meest bestudeerde is een 8-Oxo-7, 8-dihydroguanine (8-oxoGua) of 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-oxodGuo), een biomarker van oxidatively geïnduceerde basis schade in DNA. Aldehyden en epoxyaldehydes als gevolg van het lipiden peroxidatie proces zijn elektrofiele moleculen die in staat zijn mutagene exocyclic DNA adducten te vormen, zoals de etheno adducten 1,n2-etheno-2′-Deoxyguanosine (1,n2– εdGuo) en 1,n6-etheno-2′-deoxyadenosine (1,n6-εdAdo), die als potentiële biomarkers in de pathofysiologie van ontsteking zijn voorgesteld. Selectieve en gevoelige methoden voor de kwantificering ervan in DNA zijn noodzakelijk voor de ontwikkeling van preventieve strategieën om de mutaties van cellen en de ontwikkeling van chronische ziekten te vertragen (bijv. kanker, neurodegeneratieve ziekten). Onder de gevoelige methoden die beschikbaar zijn voor hun detectie (hoge prestaties vloeibare chromatografie gekoppeld aan elektrochemische of tandem massaspectrometrie detectoren, Comet Assay, immunoassays, 32P-postlabeling), de meest selectieve zijn die op basis op hoge prestaties vloeibare chromatografie gekoppeld aan tandem massaspectrometrie (HPLC-ESI-MS/MS). Selectiviteit is een essentieel voordeel bij het analyseren van complexe biologische monsters en HPLC-ESI-MS/MS geëvolueerd als de gouden standaard voor de kwantificering van gemodificeerde nucleosiden in biologische matrices, zoals DNA, urine, plasma en speeksel. Het gebruik van isotopically gelabeld interne normen voegt het voordeel van correcties voor molecule verliezen tijdens de DNA-hydrolyse en analyt verrijking stappen, alsmede voor de verschillen van de analyt ionisatie tussen de monsters. Het helpt ook bij de identificatie van de juiste chromatografie piek wanneer er meer dan een piek aanwezig is.
We presenteren hier gevalideerd gevoelige, accurate en nauwkeurige HPLC-ESI-MS/MS methoden die met succes werden toegepast voor de kwantificering van 8-oxodGuo, 1,n6-Dado en 1,N2-dGuo in de Long-, lever-en nier-DNA van A/J muizen voor de beoordeling van de effecten van ambient PM2,5 blootstelling.
Introduction
Sommige reactieve zuurstofsoorten (ROS) kunnen koolstof dubbele banden van de basissen van DNA en sommige koolstof in deoxyribose moiety oxideren, die geoxideerde basissen en de bundel onderbrekingen van DNA produceert1. Als een negatief geladen molecuul rijk aan stikstof-en zuurstofatomen, DNA is ook een doelwit voor elektrofiele groepen die covalente reageren met de nucleofiele sites (stikstof en zuurstof), het geven van producten die worden genoemd DNA adducten2. Dus, DNA-adducten en geoxideerde DNA-bases zijn voorbeelden van DNA-laesies die nuttig zijn biomarkers voor de toxiciteit beoordeling van stoffen die zijn elektrofiele, het genereren van reactieve elektrofielen op biotransformatie, of induceren oxidatieve stress1, 2. Hoewel de gewijzigde DNA-bases kunnen worden verwijderd uit DNA door base of nucleotide accijns reparatie (BER of NER), de inductie van een onbalans tussen de generatie en verwijdering van DNA-laesies in het voordeel van de voormalige leidt tot een netto stijging van hun niveau in DNA overwerk3 . Resultaten zijn de toename van de DNA-mutatie, verminderde genexpressie, en verminderde eiwit activiteit2,4,5,6,7, effecten die nauw verwant zijn aan de ontwikkeling van ziekten. De veranderingen van DNA kunnen diverse cellulaire functies, zoals cel signalering, cel cyclus, de integriteit van het genoom, Telomere stabiliteit, de epigenome, chromatin structuur, het verbinden van RNA, eiwit homeostase, metabolisme, apoptosis, en de differentiatie van de cel beïnvloeden8 ,9. Strategieën om de mutatie tarieven van cellen en de ontwikkeling van chronische ziekten (bijv. kanker, neurodegeneratieve ziekten) te vertragen passeren de kennis van de mutatie bronnen, onder hen, DNA laesies en hun oorzaken.
ROS gegenereerd endogene in overmaat, als gevolg van blootstelling aan verontreinigende stoffen, aanhoudende ontsteking, ziekte Pathofysiologie (bijv. diabetes), enz., zijn belangrijke oorzaken van Biomolecuul schade, met inbegrip van DNA en lipide schade1. Als voorbeeld, de zeer reactieve hydroxyl radicale (OH) gevormd uit H2O2 reductie door overgang metaalionen (FE2 +, Cu+) oxideert de DNA-bases, DNA-suiker moiety en meervoudig onverzadigde vetzuren bij diffusie-gecontroleerde tarieven10. Onder de 80 reeds gekenmerkt geoxideerd nucleobasen3, de meest bestudeerde is een 8-Oxo-7, 8-dihydroguanine (8-oxoGua) of 8-Oxo-7, 8-dihydro-2′-deoxyguanosine (8-OxodGuo, Figuur 1), een laesie die in staat is om te induceren gt-transversies in zoogdiercellen10,11. Het wordt gevormd door de mono elektronische oxidatie van guanine, of door hydroxyl radicale of singlet zuurstof aanval van Guanine in DNA1. Meervoudig onverzadigde vetzuren zijn andere belangrijke doelstellingen van zeer reactieve oxidanten, zoals •Oh, die het proces van lipide peroxidatie1,12te initiëren. Het geeft aanleiding tot vetzuur waterstof peroxiden die kunnen ontbinden aan elektrofiele aldehyden en epoxyaldehydes, zoals malondialdehyde, 4-hydroxy-2-nonenal, 2, 4-decadienal, 4,5-epoxy-(2E)-Decena, hexenal, acroleïne, Crotonaldehyde, die bekwaam om mutagene exocyclic te vormen DNA adducten, zoals malondialdehyde-, Propano-, of etheno adducten1,12,13. De etheno adducten 1,n2-etheno-2′-Deoxyguanosine (1,n2-εdGuo, Figuur 1) en 1,n6-etheno-2′-deoxyadenosine (1,n6-εdAdo, Figuur 1 ) zijn voorgesteld als potentiële biomarkers in de pathofysiologie van ontsteking14,15.
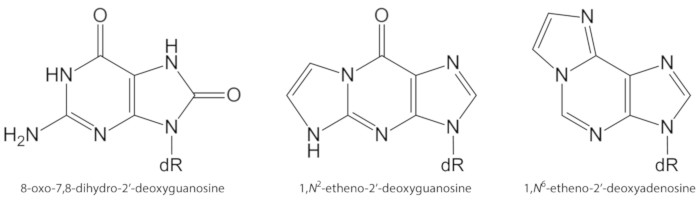
Figuur 1. Chemische structuren van de DNA-laesies gekwantificeerd in de huidige studie. dR = 2 ´-deoxyribose. Dit cijfer is gewijzigd van Oliveira et al.34. Klik hier om een grotere versie van dit cijfer te bekijken.
De studies die in de vroege jaren ‘ 80 worden uitgevoerd lieten de gevoelige opsporing van 8-oxodGuo door hoge prestaties vloeibare chromatografie toe die aan elektrochemische opsporing wordt gekoppeld (HPLC-ECD). De kwantificering van 8-oxodGuo door HPLC-ECD in verscheidene biologische systemen die aan oxiderende voorwaarden worden onderworpen leidde tot de erkenning van 8-oxodGuo als biomarker van oxidatively veroorzaakte basis schade in DNA1,16. Hoewel robuust en waardoor de kwantificering van 8-oxodGuo in de lage fmol bereik17, HPLC-ECD metingen vertrouwen op de nauwkeurigheid van de analyt retentietijd voor de identificatie van de analyt en op de chromatografie resolutie om interferenties te voorkomen van andere monster bestanddelen. Aangezien de elektrochemische opsporing het gebruik van zout (b.v., kaliumfosfaat, natriumacetaat) in de mobiele fase vereist, vergt het behoud van adequate analytische voorwaarden routine kolom en materiaal het schoonmaken tijd.
Als alternatief, het gebruik van de bacteriële DNA-reparatie enzym formamidopyrimidine DNA glycosylase (FPG) en, daarna, menselijke 8-oxoguanine glycosylase 1 (hOGG1), voor de opsporing en verwijdering van 8-oxoGua van DNA, ontstond als een manier voor de inductie van DNA-alkali labiele Sites. De alkali labiele plaatsen worden omgezet in de bundel onderbrekingen van DNA en laten de zeer hoge gevoelige indirecte kwantificering van 8-oxoGua door alkalische enige Elektroforese van het gel (de “komeet assay”) toe. De hoge gevoeligheid en de verwezenlijking van de analyses zonder de behoefte aan cellulaire DNA-extractie zijn de belangrijkste voordelen van dit type van analyse. Het geeft de laagste steady-state niveaus van 8-oxoGua in DNA, meestal 7-10 keer lager dan de niveaus verkregen door bioanalytische methoden op basis van HPLC. Het is echter een indirecte meting van 8-oxoGua en sommige nadelen zijn het gebrek aan specificiteit of de onbekende efficiëntie van de reparatie-enzymen gebruikt1,16,18.
Immunoassays zijn andere set van methoden die worden gebruikt voor de detectie van 8-oxoGua1 en exocyclic DNA adducten, zoals 1,n6-dAdo en 1,n2-dGuo12. Ondanks de gevoeligheid, is een tekortkoming van het gebruik van antilichamen voor opsporing van de letsels van DNA het gebrek aan specificiteit toe te schrijven aan cross-reactiviteit aan andere componenten van biologische steekproeven, met inbegrip van de normale DNA-basissen1,12. De exocyclic DNA adducten, met inbegrip van 1,n6-Dado en 1,n2-dGuo, kan ook worden gedetecteerd en gekwantificeerd door zeer gevoelige 32P-postlabeling assays12. De hoge gevoeligheid van 32P-postlabeling staat het gebruik van zeer kleine hoeveelheden DNA toe (b.v., 10 µ g) voor opsporing van ongeveer 1 adduct per 1010 normale basissen19. Echter, het gebruik van radio-chemicaliën, gebrek aan chemische specificiteit en lage nauwkeurigheid zijn enkele nadelen19,20.
Een gemeenschappelijke beperking van de hierboven aangehaalde methoden is de geringe selectiviteit of specificiteit voor de detectie van de gewenste moleculen. In dit scenario, HPLC gekoppeld aan electrospray ionisatie tandem massaspectrometrie (HPLC-ESI-MS/MS en HPLC-MS3) geëvolueerd als de gouden standaard voor de kwantificering van gemodificeerde nucleosiden in biologische matrices, zoals DNA, urine, plasma en speeksel 1 , 19 , 20. voordelen van HPLC-ESI-MS/MS methoden zijn de gevoeligheid (meestal in de lage fmol bereik) en de hoge specificiteit die door i) de chromatografie scheiding, II) de karakteristieke en bekende patroon van molecule fragmentatie in de massa de botsings kamer van de spectrometer, en III) de nauwkeurige meting van de geselecteerde massa aan lasten verhouding (m/z) in veelvoudige reactie controle wijze1,19. Het gebruik van isotopically gelabeld interne normen voegt het voordeel van correcties voor molecule verliezen tijdens de DNA-hydrolyse en analyt verrijking stappen, alsmede voor de verschillen van de analyt ionisatie tussen de monsters. Het helpt ook bij de identificatie van de juiste chromatografie piek wanneer meer dan een piek aanwezig is1,12,19,20.
Verschillende methoden op basis van HPLC-ESI-MS/MS zijn gebruikt voor de kwantificering van 8-oxodGuo, 1,n6-dAdo en 1,n2-dGuo in DNA geëxtraheerd uit verschillende biologische monsters12,15,20 ,21,22,23,24,25,26,27,28,29 . De fijne deeltjes (PM2,5) dragen organische en anorganische chemische producten, zoals polycyclische aromatische koolwaterstoffen (pak’s), Nitro-pak’s, aldehyden, ketonen, carbonzuren, quinolines, metalen, en in water oplosbare ionen, die ontsteking kunnen veroorzaken en oxidatieve stress, voorwaarden die het voorkomen van biomolecule schade en ziekte30,31,32,33gunst. We presenteren hier gevalideerd HPLC-ESI-MS/MS methoden die met succes werden toegepast voor de kwantificering van 8-oxodGuo, 1,n6-Dado en 1,n2-dGuo in Long-, lever-en nier-DNA van A/J muizen voor de beoordeling van de effecten van ambient PM2,5 exposure34.
Protocol
Representative Results
Discussion
Een groot probleem dat in de 8-oxodGuo analyses door HPLC methodes wordt gevonden is de mogelijke inductie van zijn vorming tijdens de Workup procedures van de extractie van DNA, de hydrolyse van DNA, en concentratie van DNA eiwithydrolysaten22,38. Om het probleem van 8-oxodGuo artefactuele vorming te minimaliseren, wordt het aanbevolen de toevoeging van deferoxamine aan alle DNA-extractie, opslag en hydrolyse oplossingen, het gebruik van de Natriumjodide chaotro…
Declarações
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do de São Paulo, proc. 2012/22190-3 en 2012/08616-8), CNPq (proc. 454214/2014-6 en 429184/2016-6), Kaap, PRPUSP (Pró-Reitoria de Pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPEs/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPEs; Proc. 573530/2008-4), NAP Redoxoma (PRPUSP; Proc. 2011.1.9352.1.8) en CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira en A. A. F. Oliveira kregen beurzen van FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) en CAPEs (Coordenação de Aperfeiçoamento de Pessoa de nível Superior). M. H. G. Medeiros, P. di Mascio, P. H. N. Saldiva, en A. P. M. Loureiro ontvangen beurzen van CNPq.
Sommige figuren en tabellen in dit werk werden oorspronkelijk gepubliceerd in Oliveira A.A.F. et al. epigenotoxic effecten in muizen blootgesteld aan geconcentreerde fijn stofdeeltjes (PM2,5) uit São Paulo stad, Brazilië. Deeltjes-en vezel toxicologie. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
Referências
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Bioquímica. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

