Quantificazione di tre lesioni del DNA mediante spettrometria di massa e valutazione dei loro livelli nei tessuti di topi esposti a particolato fine ambientale
Summary
Descriviamo qui metodi per la quantificazione sensibile e accurata delle lesioni 8-oxo-7, 8-diidro-2′-deossiguanosina (8-oxodGuo), 1,n6-etheno-2′-deossiadenosina (1,n6-dAdo) e 1,n2– etheno-2a ‘-deossiguanosina (1,N2-DGUO) nel DNA. I metodi sono stati applicati alla valutazione degli effetti del particolato fine ambientale (PM2,5) nei tessuti (polmone, fegato e rene) dei topi a/J esposti.
Abstract
Gli addotti del DNA e le basi di DNA ossidato sono esempi di lesioni del DNA che sono biomarcatori utili per la valutazione della tossicità di sostanze che sono elettrofiliche, generano elettrofili reattivi sulla biotrasformazione o inducono lo stress ossidativo. Tra i nucleobasi ossidati, il più studiato è 8-oxo-7, 8-diidroguanina (8-oxoGua) o 8-oxo-7, 8-diidro-2′-deossiguanosina (8-oxodGuo), un biomarcatore di danno di base ossidativamente indotto nel DNA. Aldeidi ed epoxyaldeidi risultanti dal processo di perossidazione lipidica sono molecole elettrofiliche in grado di formare addotti mutageni del DNA esociclico, come gli addotti addotti 1,n2-addotti-2′-deoxyguanosina (1,n2– εdGuo) e 1,n6-etheno-2′-deossiadenosina (1,n6-εdado), che sono stati suggeriti come potenziali biomarcatori nella fisiopatologia dell’infiammazione. Metodi selettivi e sensibili per la loro quantificazione nel DNA sono necessari per lo sviluppo di strategie preventive per rallentare i tassi di mutazione cellulare e lo sviluppo di malattie croniche (ad esempio, cancro, malattie neurodegenerative). Tra i metodi sensibili disponibili per la loro rilevazione (cromatografia liquida ad alte prestazioni accoppiata ai rivelatori di spettrometria di massa elettrochimica o tandem, test Comet, immunodosaggi, 32P-postetichettatura), le più selettive sono quelle basate su cromatografia liquida ad alte prestazioni accoppiata alla spettrometria di massa tandem (HPLC-ESI-MS/MS). La selettività è un vantaggio essenziale nell’analisi di campioni biologici complessi e l’HPLC-ESI-MS/MS si è evoluto come lo standard Gold per la quantificazione dei nucleosidi modificati nelle matrici biologiche, come il DNA, l’urina, il plasma e la saliva. L’uso di standard interni con etichetta isotopica aggiunge il vantaggio delle correzioni per le perdite di molecola durante le fasi di arricchimento dell’idrolisi e dell’analita del DNA, nonché per le differenze di ionizzazione dell’analita tra i campioni. Aiuta anche a identificare il picco cromatografico corretto quando è presente più di un picco.
Qui vi presentiamo i metodi HPLC-ESI-MS/MS, sensibili, accurati e precisi, che sono stati applicati con successo per la quantificazione di 8-oxodGuo, 1,n6-dado e 1,n2-DGUO nel polmone, nel fegato e nel DNA dei reni dei topi a/J per valutazione degli effetti dell’esposizione ambientale PM2,5 .
Introduction
Alcune specie reattive dell’ossigeno (ROS) sono in grado di ossidare doppi legami di carbonio di basi di DNA e alcuni carboni nella frazione desossribosio, generando basi ossidate e rottura del filamento del DNA1. Come una molecola carica negativamente ricca di atomi di azoto e ossigeno, il DNA è anche un bersaglio per i gruppi elettrofilici che covalentemente reagiscono con i siti nucleofili (azoto e ossigeno), dando prodotti che sono chiamati addotti del DNA2. Quindi, gli addotti del DNA e le basi del DNA ossidato sono esempi di lesioni del DNA che sono biomarcatori utili per la valutazione della tossicità di sostanze che sono elettrofiliche, generano elettrofili reattivi sulla biotrasformazione, o inducono lo stress ossidativo1, 2. il Anche se le basi di DNA modificate possono essere rimosse dal DNA per riparazione di escissione di base o nucleotide (BER o NER), l’induzione di uno squilibrio tra la generazione e la rimozione delle lesioni del DNA a favore della prima porta ad un aumento netto dei loro livelli nel lavoro straordinario del DNA3 . I risultati sono l’aumento dei tassi di mutazione del DNA, la riduzione dell’espressione genica e la diminuita attività proteica2,4,5,6,7, effetti che sono strettamente correlati alla sviluppo di malattie. Le mutazioni del DNA possono influenzare diverse funzioni cellulari, come la segnalazione cellulare, il ciclo cellulare, l’integrità del genoma, la stabilità dei telomeri, l’epigenoma, la struttura della cromatina, lo splicing dell’RNA, l’omeostasi proteica, il metabolismo, l’apoptosi e la differenziazione cellulare8 ,9. Le strategie per rallentare i tassi di mutazione cellulare e lo sviluppo di malattie croniche (ad esempio, cancro, malattie neurodegenerative) passano attraverso la conoscenza delle fonti di mutazione, tra cui le lesioni del DNA e le loro cause.
ROS ha generato in eccesso in modo endogeno, a causa di esposizione di inquinanti, infiammazione persistente, patofisiologia della malattia (ad esempio, diabete), ecc., sono cause importanti di danni biomolecola, tra cui il danno del DNA e del lipido1. Ad esempio, il radicale idrossile altamente reattivo (OH) formato da H2O2 riduzione degli ioni metallici di transizione (Fe2 +, cu+) ossida le basi del DNA, la porzione di zucchero del DNA e gli acidi grassi polinsaturi a diffusione controllata tassi di cambio10. Tra i 80 già caratterizzati nucleobasi ossidate3, l’uno più studiato è 8-oxo-7, 8-diidroguanina (8-oxoGua) o 8-oxo-7, 8-dihydro-2′-deossiguanosina (8-oxodGuo, Figura 1), una lesione che è in grado di indurre le trasversioni gt in cellule di mammifero10,11. È formata dall’ossidazione mono-elettronica della guanina, o da un attacco di ossigeno radicale idrossile o singollet di guanina nel DNA1. Gli acidi grassi polinsaturi sono altri importanti bersagli di ossidanti altamente reattivi, quali •Oh, che avviano il processo di perossidazione lipidica1,12. Dà origine a idroperossidi di acidi grassi che possono decomporre a aldeidi elettrofiliche ed epoxyaldeidi, come malondialdeide, 4-idrossi-2-nonenal, 2, 4-decadienal, 4,5-epossidico-(2E)-decenale, hexenal, Acrolein, crotonaldeide, che sono in grado di formare addotti mutageni del DNA esociclico, come malondialdeide-, propano-, o addotti di addotti1,12,13. L’addotti addotti 1,n2-addotti-2′-deoxyguanosine (1,n2-εdguo, Figura 1) e 1,n6-addotti-2′-deossiadenosina (1,n6-εdado, Figura 1 ) sono stati suggeriti come potenziali biomarcatori nella patofisiologia dell’infiammazione14,15.
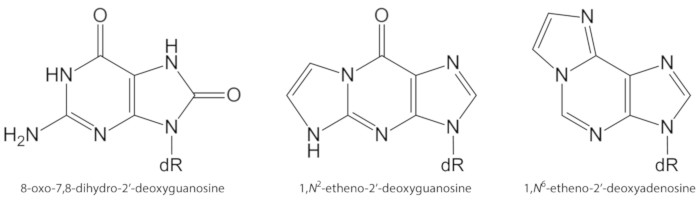
Figura 1. Strutture chimiche delle lesioni del DNA quantificate nel presente studio. dR = 2 ́-desossribosio. Questa cifra è stata modificata da Oliveira et al.34. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
Gli studi condotti nei primi anni ottanta hanno permesso la rilevazione sensibile di 8-oxodGuo mediante cromatografia liquida ad alte prestazioni accoppiata al rilevamento elettrochimico (HPLC-ECD). Quantificazione di 8-oxodGuo da HPLC-ECD in diversi sistemi biologici sottoposti a condizioni ossidanti ha portato al riconoscimento di 8-oxodGuo come un biomarcatore di danno base ossidativamente indotto in DNA1,16. Sebbene robusto e che consenta la quantificazione di 8-oxodGuo nella gamma bassa fmol17, le misurazioni HPLC-ECD si basano sull’accuratezza del tempo di ritenzione dell’analita per l’identificazione dell’analita e sulla risoluzione della cromatografia per evitare interferenze di altri costituenti campione. Poiché la rilevazione elettrochimica richiede l’uso di sale (ad esempio fosfato di potassio, acetato di sodio) nella fase mobile, il mantenimento di condizioni analitiche adeguate necessita di routine di pulizia delle colonne e delle attrezzature.
In alternativa, l’uso dell’enzima di riparazione del DNA batterico formamidopirimidina DNA glicosilasi (FPG) e, successivamente, umana 8-oxoguanina glicosilasi 1 (hOGG1), per il rilevamento e la rimozione di 8-oxoGua dal DNA, è emerso come un modo per l’induzione del DNA alcalino labile Siti. I siti alcalini labili vengono convertiti in rotture del filamento del DNA e consentono la quantificazione indiretta molto elevata sensibile di 8-oxoGua mediante elettroforesi di gel monocellulare alcalina (“saggio Comet”). L’alta sensibilità e la realizzazione delle analisi senza la necessità di estrazione del DNA cellulare sono i principali vantaggi di questo tipo di saggio. Fornisce i livelli più bassi di stato stazionario di 8-oxoGua nel DNA, tipicamente 7-10 volte inferiori ai livelli ottenuti dai metodi bioanalitici basati su HPLC. Tuttavia, è una misura indiretta di 8-oxogua e alcuni inconvenienti sono la mancanza di specificità o l’efficienza sconosciuta degli enzimi di riparazione utilizzati1,16,18.
Gli immunodosaggi sono altri metodi utilizzati per la rilevazione di addotti di 8-oxoGua1 e di DNA esociclico, come 1,n6-dAdo e 1,n2-dGuo12. Nonostante la sensibilità, una carenza dell’uso di anticorpi per il rilevamento delle lesioni del DNA è la mancanza di specificità a causa della reattività incrociata ad altri componenti di campioni biologici, comprese le normali basi di DNA1,12. Gli addotti del DNA exociclico, compresi 1, n6-dado e 1, n2-dGuo, possono essere rilevati e quantificati da 32P-saggi di postetichettatura12. L’elevata sensibilità di 32P-postetichettatura consente l’uso di piccolissime quantità di DNA (ad es. 10 μg) per il rilevamento di circa 1 addotto per 1010 basi normali19. Tuttavia, l’uso di radio-chimiche, mancanza di specificità chimica e bassa precisione sono alcuni svantaggi19,20.
Una limitazione condivisa dei metodi citati sopra è la bassa selettività o specificità per la rilevazione delle molecole desiderate. In questo scenario, l’HPLC accoppiato alla spettrometria di massa tandem a ionizzazione elettrospray (HPLC-ESI-MS/MS e HPLC-MS3) si è evoluto come lo standard Gold per la quantificazione dei nucleosidi modificati nelle matrici biologiche, come il DNA, l’urina, il plasma e la saliva 1 il , 19 anni di , 20. i vantaggi dei metodi HPLC-ESI-MS/MS sono la sensibilità (tipicamente nella gamma bassa fmol) e l’elevata specificità fornita da i) la separazione cromatografica, II) il modello caratteristico e noto della frammentazione molecolare all’interno della massa Camera di collisione dello spettrometro, e III) la misurazione accurata del rapporto massa/carica selezionato (m/z) in modalità di monitoraggio a reazione multipla1,19. L’uso di standard interni con etichetta isotopica aggiunge il vantaggio delle correzioni per le perdite di molecola durante le fasi di arricchimento dell’idrolisi e dell’analita del DNA, nonché per le differenze di ionizzazione dell’analita tra i campioni. Aiuta anche a identificare il picco cromatografico corretto quando più di un picco è presente1,12,19,20.
Diversi metodi basati su HPLC-ESI-MS/MS sono stati utilizzati per la quantificazione di 8-oxodGuo, 1,N6-dAdo e 1,n2-dGuo nel DNA Estratto da diversi campioni biologici12,15,20 ,21,22,23,24,25,26,27,28,29 . Le particelle sottili (PM2,5) trasportano sostanze chimiche organiche e inorganiche, quali idrocarburi policiclici aromatici (IPA), Nitro-IPA, aldeidi, chetoni, acidi carbossilici, chinolini, metalli e ioni solubili in acqua, che possono indurre infiammazione e stress ossidativo, condizioni che favoriscono il verificarsi di biomolecola danni e malattia30,31,32,33. Qui presentiamo i metodi HPLC-ESI-MS/MS convalidati che sono stati applicati con successo per la quantificazione di 8-oxodGuo, 1,n6-dado e 1,n2-dGuo in polmone, fegato e DNA renale di un/J topi per la valutazione del effetti dell’esposizione ambientale PM 2,534.
Protocol
Representative Results
Discussion
Un problema importante riscontrato nelle analisi 8-oxodGuo da HPLC Metodi è la possibile induzione della sua formazione durante le procedure di esame di estrazione del DNA, idrolisi del DNA, e la concentrazione di DNA idrolizzati22,38. Al fine di minimizzare il problema della formazione di 8-oxodGuo smontava, si raccomanda l’aggiunta di deferossamina a tutte le soluzioni di estrazione, stoccaggio e idrolisi del DNA, l’uso del metodo chaotropico ioduro di sodio e…
Declarações
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do Estado de São Paulo, proc. 2012/22190-3 e 2012/08616-8), CNPq (proc. 454214/2014-6 e 429184/2016-6), Mantes, PRPUSP (PRÓ-Reitoria de Pesquisa da Universidade de São Paulo), into INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), Redoxoma INCT (FAPESP/CNPq/Mantes; Proc. 573530/2008-4), Redoxoma di NAP (PRPUSP; Proc. 2011.1.9352.1.8) e CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira e A. A. F. Oliveira hanno ricevuto borse di studio da FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) e CAPES (coordenação de aperfeiçoamento de pessoal de nível Superior). M. H. G. Medeiros, P. di mascio, P. H. N. Saldiva e A. P. M. Loureiro hanno ricevuto borse di stato da CNPq.
Alcune figure e tavole presenti in questo lavoro sono state originariamente pubblicate in Oliveira A.A.F. et al. effetti genotossici ed epigenotossici nei topi esposti a particolato fine ambiente concentrato (PM2,5) da San Paolo, Brasile. Tossicologia delle particelle e delle fibre. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
Referências
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Bioquímica. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

