질량 분 광 법에 의해 3 개의 DNA 병 변의 정량화 및 주변 미세 입자 상 물질에 노출 된 마우스의 조직에서 그들의 수준에 대 한 평가
Summary
우리는 병 변의 민감하고 정확한 정량화를 위한 방법을 여기에 설명 합니다. 8-옥 소-7, 8 디 하이드로 deoxyguanosine),1n6조-2-deoxyadenosine 및1, n6조-2dado deoxyguanosine (1,n2-dguo) DNA에. 이 방법은 노출 된 A/J 마우스의 조직 (폐, 간 및 신장)에서 주변 미세 미 립 자 물질 (PM2.5)의 영향에 대 한 평가에 적용 되었다.
Abstract
Dna 시드와 및 산화 된 dna 기지는 잔기 되는 물질의 독성 평가를 위한 유용한 생물 표지 자, 생물 변환 시 반응성 전자 기적 생성, 또는 산화 적 스트레스를 유도 하는 dna 병 변의 예이다. 산화 된 핵 염기 중에서 가장 많이 연구 된 것은 DNA에 산화 적으로 유도 된 기본 손상의 바이오 마커로 서 8-옥 소-7, 8 dihydroguanine (8 옥 소 구 아) 또는 8 옥 소 다이-deoxyguanosine. 지질 과산화 과정에서 기인 하는 알 데히드 및에 폭 자일로는 잔기 분자 exocyclic DNA 시드와와 같은 돌연 변이를 형성할 수 있게 되는데,이에 노 다 덕트 1,n2-2-deoxyguanosine εdGuo) 및 염증의병 리 생리학에서의 잠재적 바이오 마커로 서 제안 된 1,n6-deoxyadenosine-εdAdo). 세포 돌연변이 속도와 만성 질환 발달 (예: 암, 퇴행 성 신경 질환)을 느리게 하기 위한 예방 전략의 개발에는 DNA에서의 정량화를 위한 선택적이 고 민감한 방법이 필요 합니다. 검출에 사용할 수 있는 민감한 방법 중 (전기 화학적 또는 탠덤 질량 분석 검출기에 결합 된 고성능 액체 크로마토그래피, 혜성 분석 법, 면역 검사 32P-포스트 라벨링) 중에서 가장 선택적인 것은 탠덤 질량 분 광 법에 결합 된 고성능 액체 크로마토그래피 (HPLC-ESI/MS). 선택 성은 DNA, 소변, 혈장 및 타 액과 같은 생물학적 매트릭스에서 변형 된 시드의 정량화를 위한 금 표준으로 진화 된 복잡 한 생물학적 샘플 및 HPLC-ESI/MS를 분석할 때 필수적인 장점입니다. 동위 원소 표지 된 내부 표준의 사용은 DNA 가수분해 및 분석 물 농축 단계 동안 분자 손실에 대 한 교정 뿐만 아니라 샘플 간 분석 물질 이온화의 차이에 대 한 보정의 이점을 추가 합니다. 또한, 둘 이상의 피크가 존재할 때 올바른 크로마토그래피 피크를 식별 하는 데 도움이 됩니다.
우리는 여기에 A/J 마우스의 폐, 간 및 신장 DNA에 있는 8 옥 소 오 궈, 1,6-다도 및 1,n2의 정량화를 위해 성공적으로 적용 된 민감하고 정확 하 고 정밀한 HPLC-ESI/ms 방법을 제시 합니다 앰비언트 PM2.5 노출의 효과 평가.
Introduction
일부 반응성 산소 종 (ROS)는 산화 된 염기와 DNA 가닥 나누기를 생성 하는 deoxyribose 모이 어 티의 DNA 염기 및 일부 탄소의 탄소 이중 결합을 산화 할 수 있다1. 질소 및 산소 원자가 풍부한 음으로 하 전에 분자 인 dna는 dna 시드와2라고 하는 제품을 제공 하는 친 핵 성 사이트 (질소 및 산소)와 공유 적으로 반응 하는 잔기 그룹의 대상 이기도 합니다. 따라서, dna 시드와 및 산화 된 dna 기지는 잔기 물질의 독성 평가를 위한 유용한 바이오 마커로 서, 생물 변환 시 반응성 전기를 생성 하거나, 산화 적 스트레스를 유발 하는 dna 병변의 예입니다. 2. 변형 된 DNA 염기가 염기 또는 염기 절제 수리 (BER 또는 NER)에 의해 DNA 로부터 제거 될 수 있지만, dna 병 변의 생성 및 제거 사이에 불균형을 유도 하 여 전자에 찬성 하 여 유전자 초과 근무에서 자신의 수준의 순 증가에 이르게 한다3 . 결과는 DNA 변이 율의 증가, 유전자 발현 감소 및 단백질 활성 저하,도4,도6,7등의 효과가 밀접 하 게 관련 되어 있는 질병의 개발. DNA 돌연변이는 세포 신호 전달, 세포 주기, 게놈 완전성, telomere 안정성, 후 성 후 성, 크로마 틴 구조, RNA 스 플라이 싱, 단백질 항상성, 대사 및 세포 분화와 같은 다양 한 세포 기능에 영향을 미칠 수 있다8 ,9. 세포 돌연변이 속도와 만성 질환 발달을 느리게 하는 전략 (예: 암, 신경 퇴행 성 질환)은 그 중 에서도 돌연변이 원의 지식, DNA 병 변 및 그 원인 들을 통과 한다.
오염 물질 노출, 지속적인 염증, 질병 이상 (예: 당뇨병) 등으로 과잉으로 내 시경 적으로 생성 된 ROS는 DNA 및 지질 손상을 포함 한 생체 분자 손상의 중요 한 원인1입니다. 일례로 서, 전이 금속 이온 (Fe2 +, Cu+)에의 한 고 반응성 수산화 라 디 칼 (OH)이 환 원 되어 형성 된 dna 염기, dna 당 모이 어 티 및 고도 불포화 지방산을 산화 시켜 확산 조절 요금10. 80 중에서 이미 특성화 된 산화 된 뉴 클레 아 제3중 가장 많이 연구 된 것은 8 옥 소-7, 8-dihydroguanine 및 8 옥 소 다이 deoxyguanosine이 고, 도 1)에서 GT 트랜스 버전을 유도할 수 있는 병 변 포유류 세포10,11. 구 아닌의 모노 전자 산화에 의해, 또는 DNA1에서 구 아닌의 하이드 록 실 라 디 칼 또는 일 중 항 산소 공격에 의해 형성 된다. 고도 불포화 지방산은 지질 과산화1,12의 과정을 시작 하는 •OH와 같은 반응성이 높은 산화 제의 다른 중요 한 표적입니다. 이는 malondialdehyde, 4 히 드 록 시 니 알, 잔기 에폭시-데 네 날, 헥 센 날, 아크로 라인, 크로 톤 알 데히드 등의 알 데히드와에 폭 시 알데하이드로 분해 될 수 있는 지방산 하이드로 퍼 옥사이드를 상승 시켜 주며 돌연 변이 exocyclic DNA 시드와 (예: malondialdehyde), propano 또는 etheno 시드와1,13등을 형성할 수 있습니다. Deoxyguanosine, εdGuo, 그림 1및1, n 6-εdAdo,그림 1의 경우에는이에 대 한 것을 참조 하십시오 (1, 2-2). )는 염증14,15의 병 리 생리학에서 잠재적인 바이오 마커로 제안 되었다.
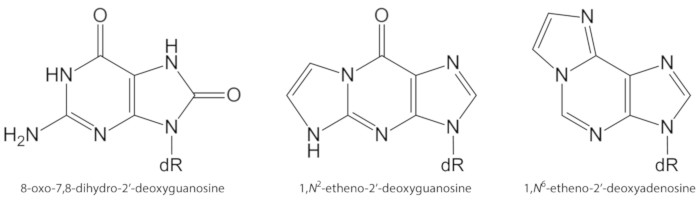
그림 1입니다. 본 연구에서 정량화 된 DNA 병 변의 화학 구조. 박사 = 2 ´-deoxyribose. 이 수치는 올리베이라 외34에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
1980 년대 초반에 수행 된 연구는 전기 화학적 검출 (HPLC-ECD)에 결합 된 고성능 액체 크로마토그래피를 통해 8 옥 소 오 궈의 민감성 검출을 허용 했습니다. 다 수의 생물학적 시스템에서 HPLC-ECD에의 한 8-옥 소 오드의 정량은 산화 성 유도 염기의 바이오 마커로 서 8 옥 소 오 궈의 인정을 받아 DNA1,16에서 손상 시켰다. 낮은 fmol 범위17에서 8-옥 소 궈의 정량화를 가능 하 게 하 고 견고 하면서 HPLC-ECD 측정은 분석 물질 식별 및 크로마토그래피 분해능에 대 한 분석 물질 보유 시간의 정확성에 의존 하 여 간섭을 방지 합니다. 다른 샘플 성분. 전기 화학적 검출은 이동 상의 염 분 (예: 인산 칼륨, 아세트산 나트륨)을 사용 해야 하므로 적절 한 분석 조건의 유지 보수에는 일상적인 칼럼 및 장비 세척 시간이 필요 합니다.
대안적으로, 세균 DNA 복구 효소 formamidopyrimidine DNA glycosylase (FPG)를 사용 하 고, 그 후, 인간 8-oxoguanine glycosylase의 검출 및 DNA 로부터 8 옥 소 구 아의 제거를 위한 DNA 알칼리의 유도를 위한 방법으로 등장 사이트. 알칼리 성 불안정 부위는 DNA 가닥 분리로 변환 되어 알칼리 단 세포 겔 전기 영동에의 한 8-옥 소 구 아의 매우 고감도 간접 정량화를 허용 한다 (“혜성 분석 법”). 세포 DNA 추출이 필요 없는 높은 민감도와 분석의 성취는 이러한 유형의 분석의 주요 장점입니다. 이는 DNA에서 가장 낮은 정상 상태 수준을 제공 하며, 일반적으로 HPLC를 기반으로 한 생물학적 분석 방법에 의해 얻어진 수준 보다 7-10 배 낮습니다. 그러나, 8 옥 소 구 아의 간접 측정은 몇 가지 단점이 있고 특이성의 결여 또는 수리 효소의 알려지지 않은 효율이1,16,18에 사용 된다.
면역 분석은 8-옥 소 구 아1 및 exocyclic DNA adducts 등의 검출에 사용 되는 다른 일련의 방법으로, 예를 들어 1,엔6-다도 및 1,n2-dado12. 민감도에도 불구 하 고, dna 병 변의 검출을 위한 항 체의 사용의 단점은 정상적인 dna 염기1,12를 포함 하는 생물학적 샘플의 다른 성분 들에 대 한 교차 반응성으로 인 한 특이성의 결여 이다. Exocyclic DNA adducts는 1,n2-dado 및 1,n2-dado를 포함 하 여, 또한 고감도 32P-포스트 라벨링 분석 법에 의해 검출 되 고 정량화될 수 있다. 32P-포스트 라벨링의 고감도는 10 개의 정상 염기19당 약 1 개의 부가 물를 검출 하기 위해 매우 적은 양의 DNA (예를 들어 10 µ g) 를 사용할 수 있게 한다. 그러나, 무선 화학 물질의 사용, 화학적 특이성의 결여 및 낮은 정확도는19,20의 몇 가지 단점이 있다.
상기 언급 된 방법의 공유 제한은 원하는 분자의 검출을 위한 낮은 선택성 또는 특이성 이다. 이 시나리오에서 전기 분무 이온화 탠덤 질량 분 광 법 (HPLC-ESI-MS/MS 및 HPLC-MS3)에 결합 된 HPLC는 DNA, 소변, 혈장 및 타 액과 같은 생물학적 매트릭스에서 변형 된 시드의 정량화를 위한 금 표준으로 발전 했습니다. 1 , 19 , 20. HPLC-ESI의 장점 (통상적으로 낮은 fmol 범위에서) 및 크로마토그래피 분리에 의해 제공 되는 높은 특이성, ii) 분자의 특성 및 공지 된 패턴이 질량 내부 단편화 및 iii) 다중 반응 모니터링 모드에서 선택 된 질량을 충전 비율 (m/z)에 대 한 정확한 측정이1,19. 동위 원소 표지 된 내부 표준의 사용은 DNA 가수분해 및 분석 물 농축 단계 동안 분자 손실에 대 한 교정 뿐만 아니라 샘플 간 분석 물질 이온화의 차이에 대 한 보정의 이점을 추가 합니다. 또한1개,12,19,20이상의 피크가 존재할 때 정확한 크로마토그래피 피크를 식별 하는 데 도움을 준다.
HPLC-ESI/ms에 기초한 몇 가지 방법은 상이한 생물학적 샘플 로부터 추출 된 8 옥 소 오 궈, 1,엔6-다도 및 1,n2-dado의 정량 분석을 위해 사용 되었다12,20 ,21,26,27,28,29 . 미 립 자 (PM2.5)는 염증을 유도할 수 있는 다 환 방향족 탄화수소 (pahs), 니트로 pahs, 알 데히드, 케 톤, 카 르 복 실 산, 퀴 놀 린, 금속 및 수용 성 이온과 같은 유기 및 무기 화학 물질을 운반 합니다. 산화 적 스트레스, 생체 분자 손상 및 질병의 발생을 선호 하는 조건30,31,32,33. 이 하, 본 원에 대 한 평가를 위하여 A/J 마우스의 폐, 간 및 신장 DNA에 8-옥 소 오그의 정량화를 위해 성공적으로 적용된 HPLC-ESI/ms 방법에 대 한 검증을 실시 하 고 있습니다. 앰비언트 PM2.5 노출34의 효과.
Protocol
Representative Results
Discussion
HPLC 방법에의 한 8-옥 시 오드 구 오 분석에서 발견 되는 주요 문제점은 dna 추출, dna 가수분해 및 dna 가수분해 물의 농축 과정 중에 그 형성의 유도가22,38이다. 8-옥 시 오 스의 아 티 사실 형성의 문제를 최소화 하기 위하여, 모든 DNA 추출, 저장 및 가수분해 용액에 지연 소 아민을 첨가 하는 것이 좋으며,이는 요오드 화 나트륨의 사용과 DNA 추출 시 페 놀의 …
Declarações
The authors have nothing to disclose.
Acknowledgements
Universidade 및 2012/08616-8 429184/2016-6 454214/2014-6), INCT 나이 라 (Pó-reitas 드 페 스 퀘이 사 다이 라 데 상 파울로), 프라 푸 프 (Pró-이 라이 타로 데 페 사 다스), 트 라이 라 (cccfpq) 2012/22190-3 채찍/파 마/자 위; 573813/2008-6), INCT Redoxoma (대 본) 573530/2008-4), NAP Redoxoma (PRPUSP; 2011.1.9352.1.8) 및 CEPID Redoxoma 2013/07937-8). (2012/21636-8, 2011/09891-0, 2012/08617-4) 및 망 토에의 한 장학금을 수 여 받았다 (이에 대 한 자세한 내용은이에 대 한)를 제공 하는 것입니다. M. h. 메 데이 루스, p. 디 마 시 오, p. 에이치. 살 디바, 그리고 p. m. Loureiro는 CNPq에서 펠로 우 십을 받았다.
이 작품에 존재 하는 일부 수치와 표는 원래 올리베이라 A.A.F. et al에 출판 되었습니다. 브라질 상파울로 시에서 집중 된 주변 미세 미 립 자 물질 (PM2.5)에 노출 된 쥐에서의 유전 독성 및 후에독성 효과. 입자 및 섬유 독성 학. 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
Referências
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Bioquímica. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

