Uso de embriones de pez cebra Tg(Vtg1:mcherry) para probar los efectos estrogénicos de los compuestos disruptores endocrinos
Summary
Presente aquí es un protocolo detallado para el uso de embriones de pez cebra Tg(vtg1: mCherry) para la detección de efectos estrogénicos. El protocolo abarca la propagación de los peces y el tratamiento de embriones, y hace hincapié en la detección, documentación y evaluación de señales fluorescentes inducidas por compuestos disruptores endocrinos (EDC).
Abstract
Hay muchos compuestos disruptores endocrinos (EDC) en el medio ambiente, especialmente sustancias estrogénicas. La detección de estas sustancias es difícil debido a su diversidad química; por lo tanto, se utilizan cada vez más métodos de detección de efectos, como los organismos biomonitor/bioindicador sensibles al efecto estrogénico. Estos organismos biomonitores incluyen varios modelos de peces. Este protocolo abarca el uso de la línea transgénica Tg(vtg1: mCherry) de peces cebra como organismo biomonitorio, incluida la propagación de peces y el tratamiento de embriones, con énfasis en la detección, documentación y evaluación de señales fluorescentes inducidas por la EDC. El objetivo del trabajo es la demostración del uso de los embriones de línea transgénica Tg(vtg1: mCherry) para detectar efectos estrogénicos. Este trabajo documenta el uso de embriones transgénicos de pez cebra Tg(vtg1: mCherry) para la detección de efectos estrogénicos mediante la prueba de dos sustancias estrogénicas, el zearalenol. El protocolo descrito es sólo una base para diseñar ensayos; el método de prueba puede variar según los puntos finales de prueba y las muestras. Además, puede combinarse con otros métodos de ensayo, facilitando así el uso futuro de la línea transgénica.
Introduction
Hay un número significativo de compuestos disruptores endocrinos (EDC) que se encuentran entre las sustancias más peligrosas en nuestro medio ambiente. Estos son principalmente compuestos estrogénicos que contaminan el agua de los recursos naturales. La diversidad química de las sustancias pertenecientes al grupo dificulta las pruebas de su presencia, ya que se requieren diferentes métodos analíticos para su detección. Basado en su estructura química es muy difícil determinar si una sustancia es realmente capaz de actuar como un estrógeno. Además, estas sustancias nunca están presentes en forma pura en el medio ambiente, por lo que sus efectos pueden verse afectados por otros compuestos, demasiado1. Este problema se puede resolver mediante métodos de detección de efectos, como el uso de biomonitor/bioindicador organismos que muestran efectos estrogénicos2,3,4,5.
Recientemente, una variedad de línea celular6 y sistemas de prueba basados en levadura2,3 se han desarrollado para detectar efectos estrogénicos. Sin embargo, estos son generalmente sólo capaces de detectar la unión de la sustancia al receptor de estrógeno2,3. Además, son incapaces de modelar procesos fisiológicos complejos en el organismo, o para detectar fases sensibles a las hormonas de las etapas de la vida; por lo tanto, a menudo conducen a resultados falsos.
Se sabe que ciertos genes reaccionan sensiblemente al estrógeno en organismos vivos7. La detección de productos genéticos por métodos de biología molecular también es posible en el nivel de proteína o ARNm8,9, pero por lo general implica sacrificio animal. Las leyes de protección animal se han vuelto más estrictas, y existe una creciente demanda de sistemas de ensayo alternativos que minimicen el número y el sufrimiento de los animales utilizados en experimentos o la sustitución del modelo animal por otro modelo10. Con el descubrimiento de proteínas fluorescentes y la creación de líneas de biomarcadores, las tecnologías transgénicas proporcionan una buena alternativa11. Con estas líneas, la activación de un gen sensible al estrógeno se puede probar in vivo.
Entre los vertebrados, el potencial de los peces en la evaluación del riesgo ambiental es excepcional. Ofrecen muchas ventajas sobre los modelos de mamíferos: al ser organismos acuáticos, son capaces de absorber contaminantes a través de todo su cuerpo, producir un gran número de crías, y algunas de sus especies se caracterizan por un corto tiempo de generación. Su sistema endocrino y procesos fisiológicos muestran grandes similitudes con otros vertebrados e incluso con mamíferos, incluidos los humanos12.
También se conocen varios genes para la detección de efectos estrogénicos en peces. Los más importantes son los receptores de estrógeno aromatasa-b, coriogenina-H, y vitellogenina (vtg)7,13. Recientemente, varias líneas de biosensores productores de estrógenos también se han creado a partir de modelos de peces utilizados en el laboratorio, como de pez cebra (Danio rerio)4,5,14,15,16,17. La principal ventaja del pez cebra en la creación de líneas de biosensor es el cuerpo transparente de los embriones y larvas, ya que la señal de reportero fluorescente puede entonces ser fácilmente estudiada in vivo sin sacrificar al animal10. Además de la protección animal, también es una característica valiosa ya que permite estudiar la reacción del mismo individuo en diferentes momentos del tratamiento18.
Estos experimentos utilizan un reportero de vitellogenin linótez de la línea15. La construcción transgene utilizada para el desarrollo de Tg(vtg1:mCherry) tiene un largo (3,4 kbp) promotor natural vitellogenin-1. El receptor de estrógeno (ER) es una proteína potenciadora activada por ligandos que es un representante de la superfamilia de los receptores de esteroides /nuclear. ER se une a secuencias de ADN específicas llamadas elementos de respuesta de estrógeno (EERE) con alta afinidad y transactiva la expresión génica en respuesta al estradiol y otras sustancias estrogénicas, por lo que cuanto más ERE en el promotor causa una respuesta más fuerte19. Hay 17 sitios ERE en la región promotora de la construcción transgén de Tg(vtg1:mCherry) y se espera que imitan la expresión del gen vtg nativo15. Hay una expresión continua de la señal fluorescente en hembras maduradas sexualmente. Sin embargo, en varones y embriones la expresión en el hígado sólo es visible en el tratamiento con sustancias estrogénicas (Figura 1).
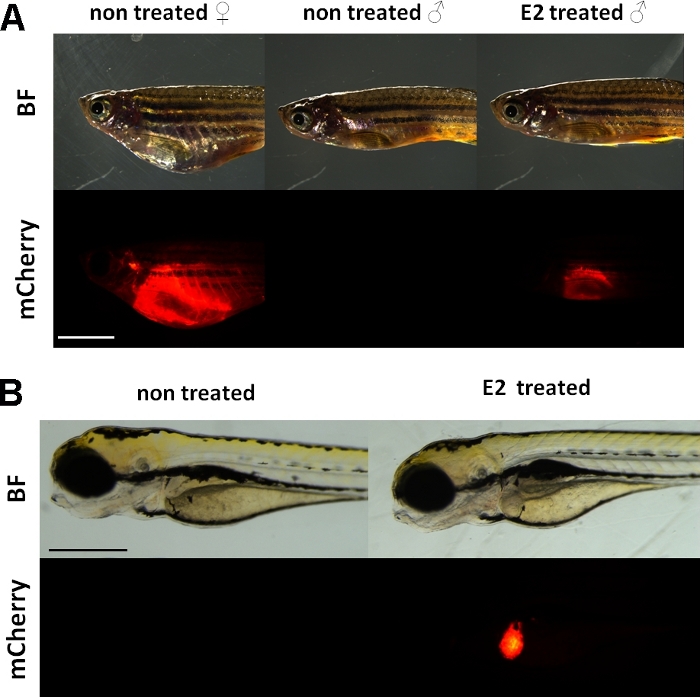
Figura 1: Señal fluorescente roja en el hígado de vg1:mCherry transgenic adult zebrafish y 5 dpf embryos, después de 17-estradiol (E2) inducción. En hembras y en hombres tratados con E2 (25 g/L de tiempo de exposición:48hrs) la fuerte fluorescencia del hígado es visible incluso a través de la piel pigmentada. No se puede ver ninguna señal fluorescente en los machos no tratados (A). Después de la inducción de E2 (50 g/L de tiempo de exposición: 0-120 hpf), también se puede observar una señal fluorescente roja en el hígado de embriones de 5 dpf, que no es visible en los embriones de control (B). Mientras que la señal fluorescente está continuamente presente en las hembras adultas, principalmente los machos y embriones de la línea son adecuados para detectar efectos estrogénicos. (BF: campo brillante, mCherry: vista de filtro fluorescente rojo, imágenes simples, barra de escala A: 5 mm, barra de escala B: 250 m) Haga clic aquí para ver una versión más grande de esta figura.
Al igual que la vitellogenina endógena, el reportero de mCherry sólo se expresa en el hígado. Debido a que la vitellogenina sólo se produce en presencia de estrógeno, no hay señal fluorescente en los controles. Debido a que la expresión está sólo en el hígado, la evaluación de los resultados es mucho más fácil15.
La sensibilidad y usabilidad de los embriones de esta línea se han investigado en diversas mezclas de compuestos estrogénicos y también en muestras ambientales15,20, y en la mayoría de los casos se documentaron las relaciones dosis-respuesta ( Figura2). Sin embargo, en el caso de sustancias altamente tóxicas, principalmente hepatotóxicas ,por ejemplo, zearalenona), sólo una señal fluorescente muy débil puede ser visible en el hígado de embriones tratados y la señal fluorescente de intensidad máxima causada puede alcanzarse dentro de un rango de concentración muy pequeño, lo que dificulta el establecimiento de relaciones dosis-efecto20.
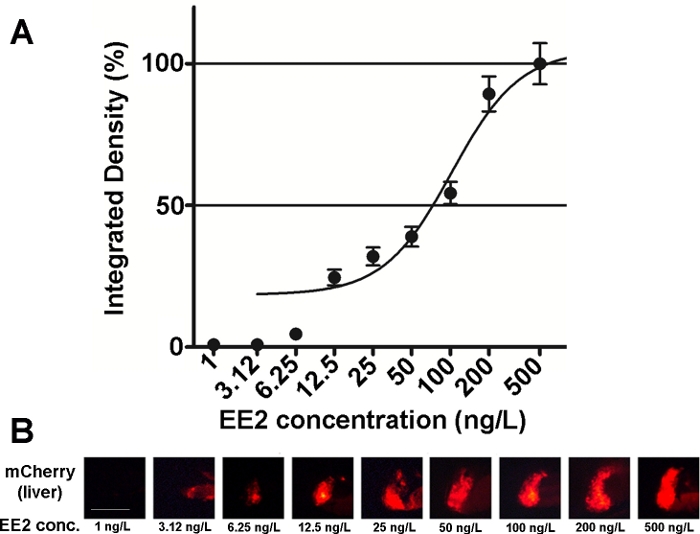
Figura 2: Diagrama de dosis-respuesta (A) e imágenes fluorescentes (mCherry) del hígado (B) expuestos a 17-etilestradiol (EE2), en 5 dpf vtg1:mCherry larvas. Los resultados se expresan como densidad integrada generada a partir de la intensidad de la señal y el tamaño de la zona afectada (-SEM, n a 60). 100% se refiere al máximo observado. La intensidad de la señal fluorescente aumentó gradualmente con la concentración. Barra de escala de 250 m. Haga clic aquí para ver una versión más grande de esta figura.
Hay varias sustancias estrogénicas presentes en el medio ambiente, tales como 17-í-estradiol (concentración ambiental: 0,1–5,1 ng/L)21, 17-etilestradiol (concentración ambiental: 0,16–0,2 g/L)22, zearalenona (concentración ambiental: 0,095–0,22 g/L)23, bisfenol-A (concentración ambiental: 0,45–17,2 mg/L)24. Al probar estas sustancias en forma activa pura con la ayuda de embriones transgénicos mCherry, las concentraciones de efecto observadas más bajas (LOEC) para la detección de signos fluorescentes fueron 100 ng/L para 17-és-estradiol, 1 ng/L para 17-etilestradiol, 100 ng/L para zearalenona y 1 mg/L para el tratamiento con bisfenol-A (96–120 hpf), que está muy cerca o dentro del rango de concentraciones ambientales de las sustancias15. La línea transgénica Tg(vtg1:mCherry) puede ayudar a detectar la estrofica en muestras de aguas residuales después de la exposición directa. La línea es tan sensible como la prueba de estrógeno de levadura de uso común, el ensayo de estrógeno de levadura bioluminiscente (BLYES)15. Con la ayuda de esta línea, se han confirmado los efectos protectores de las beta-ciclodextrinas contra la toxicidad inducida por zearalenona utilizando mezclas químicas20.
En un informe reciente, el uso in vivo de la línea transgénica se demostró con la ayuda de dos metabolitos estrogénicos de zearalenona (ZEA), los anudalenol de los ácidos (ZEA) y los a-zearalenol (a-ZOL y a-ZOL)25. La línea de base del protocolo es apropiada para estudiar los efectos estrogénicos de varios compuestos o muestras ambientales en embriones Tg(vtg1:mCherry).
Protocol
Representative Results
Discussion
El uso de biomonitores/bioindicadores para efectos estrogénicos se ha propagado en estudios toxicológicos. Los modelos in vivo desempeñan un papel sobresaliente, ya que a diferencia de las pruebas in vitro, no sólo proporcionan información sobre la respuesta de una célula o un receptor, sino que también permiten la investigación de procesos complejos en el organismo. Varias líneas transgénicas para el estudio de efectos estrogénicos se han producido a partir de peces cebra, uno de los cuales Tg(vtg1:mCherr…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabajo contó con el apoyo de la Oficina Nacional de Investigación, Desarrollo e Innovación (NKFIH) del Fondo Nacional de Investigación, Desarrollo e Innovación (NKFIA); Acuerdo de subvención: proyecto NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 cofinanciado por la Unión Europea, y el Programa de Excelencia Temática NKFIH-831-10/2019 de la Universidad Szent István, otorgado por el Ministerio de Tecnología y Innovación.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
Referências
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

