Multimodaler 3D-Druck von Phantomen zur Simulation von biologischem Gewebe
Summary
Spin-Beschichtung, Polyjet-Druck und Sicherungsabscheidungsmodellierung sind integriert, um mehrschichtige heterogene Phantome zu produzieren, die strukturelle und funktionelle Eigenschaften von biologischem Gewebe simulieren.
Abstract
Die biomedizinische optische Bildgebung spielt eine wichtige Rolle bei der Diagnose und Behandlung verschiedener Krankheiten. Die Genauigkeit und Reproduzierbarkeit eines optischen Bildgebungsgeräts wird jedoch stark von den Leistungsmerkmalen seiner Komponenten, der Testumgebung und den Vorgängen beeinflusst. Daher ist es notwendig, diese Geräte nach rückverfolgbaren Phantomstandards zu kalibrieren. Die meisten der derzeit verfügbaren Phantome sind jedoch homogene Phantome, die keine multimodalen und dynamischen Eigenschaften des biologischen Gewebes simulieren können. Hier zeigen wir die Herstellung heterogener gewebesimulierender Phantome anhand einer Produktionslinie, die ein Spin-Beschichtungsmodul, ein Polyjet-Modul, ein FDM-Modul (FUSED Deposition Modeling) und ein automatisches Steuerungsframework integriert. Die Strukturinformationen und die optischen Parameter eines “digitalen optischen Phantoms” werden in einer Prototypdatei definiert, in die Produktionslinie importiert und Schicht für Schicht mit sequentiellem Wechsel zwischen verschiedenen Druckmodalitäten hergestellt. Die technische Leistungsfähigkeit einer solchen Produktionslinie wird durch den automatischen Druck von hautsimulierenden Phantomen veranschaulicht, die die Epidermis, Dermis, subkutanes Gewebe und einen eingebetteten Tumor umfassen.
Introduction
Die biomedizinische optische Bildgebung stellt eine Familie medizinischer Bildgebungsinstrumente dar, die Krankheiten und Gewebeanomalien auf der Grundlage von Lichtwechselwirkungen mit biologischem Gewebe erkennen. Im Vergleich zu anderen bildgebenden Modalitäten wie Magnetresonanztomographie (MRT) und Computertomographie (CT) nutzt die biomedizinische optische Bildgebung die nichtinvasive Messung von strukturell, funktionellen und molekularen Gewebeeigenschaften mit kostengünstigen und tragbaren Geräten1,2,3,4. Trotz ihrer Überlegenheit in den Kosten und der Übertragbarkeit ist die optische Bildgebung für die klinische Diagnose und therapeutische Beratung jedoch nicht allgemein anerkannt, was teilweise auf die schlechte Reproduzierbarkeit und das Fehlen einer quantitativen Kartierung zwischen optischen und biologischen Parametern zurückzuführen ist. Der Hauptgrund für diese Einschränkung ist das Fehlen rückverfolgbarer Standards für die quantitative Kalibrierung und Validierung biomedizinischer optischer Bildgebungsgeräte.
In der Vergangenheit wurden eine Vielzahl von gewebesimulierenden Phantomen für die biomedizinische optische Bildgebungsforschung in verschiedenen Gewebetypen entwickelt, wie Gehirn5,6,7, Haut8,9,10,11,12, Blase13und Brustgewebe14,15,16,17. Diese Phantome werden in erster Linie durch eines der folgenden Herstellungsverfahren hergestellt: 1) Spinbeschichtung10,18 (zur Simulation homogenen und dünnschichtigen Gewebes); 2) Formung19 (zur Simulation von sperrigem Gewebe mit geometrischen Merkmalen); und 3) dreidimensionaler (3D) Druck20,21,22 (zur Simulation von mehrschichtigem heterogenem Gewebe). Haut-Phantome, die durch Formen erzeugt werden, sind in der Lage, die optischen Eigenschaften des Hautgewebes zu imitieren, können aber die seitlichen optischen Heterogenitäten nicht simulieren19. Bentz et al. verwendeten ein zweikanaliges FDM 3D-Druckverfahren, um verschiedene optische Eigenschaften des biologischen Gewebes nachzuahmen23. Die Verwendung von zwei Materialien kann jedoch die optische Heterogenität und Anisotropie des Gewebes nicht ausreichend simulieren. Lurie et al. schufen ein Blasen-Phantom für optische Kohärenztomographie (OCT) und Zystoskopie durch die Kombination von 3D-Druck und Spin-Beschichtung13. Heterogene Merkmale des Phantoms, wie Blutgefäße, mussten jedoch von Hand bemalt werden.
Unter den oben genannten Phantomfertigungsprozessen bietet der 3D-Druck die größte Flexibilität bei der Simulation der strukturellen und funktionellen Heterogenitäten von biologischem Gewebe. Viele biologische Gewebetypen, wie z. B. Hautgewebe, bestehen jedoch aus mehrschichtigen und mehrskalienierten Komponenten, die durch einen einzigen 3D-Druckprozess nicht effektiv dupliziert werden können. Daher ist die Integration mehrerer Fertigungsprozesse notwendig. Wir schlagen eine 3D-Druck-Produktionslinie vor, die mehrere Fertigungsprozesse für die automatische Herstellung von mehrschichtigen und mehrskalienigen Gewebesimulationsphantomen als rückverfolgbaren Standard für die biomedizinische optische Bildgebung integriert(Abbildung 1). Obwohl Spincoating, Polyjet-Druck und FDM in unserer 3D-Druck-Produktionslinie automatisiert sind, behält jede Modalität die gleichen funktionalen Eigenschaften wie die etablierten Prozesse. Daher bietet dieses Papier eine allgemeine Richtlinie für die Herstellung von mehrskaligen, vielschichtigen und heterogenen Gewebesimulations-Phantomen, ohne dass die physische Integration mehrerer Prozesse in einem einzigen Gerät erforderlich ist.
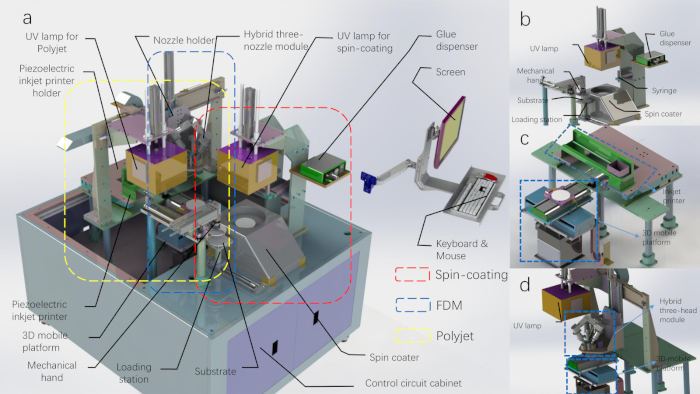
Abbildung 1: Das CAD-Diagramm der 3D-Druckfertigungslinie. (A) Die 3D-Druck-Produktionslinie mit der obersten Schale entfernt. (B) Der Schaltplan des Spin-Beschichtungsmoduls und des mechanischen Handmoduls. (C) Der Schaltplan des Polyjet-Druckmoduls. (D) Der Schaltplan des FDM-Druckmoduls (die UV-Lampe gehört zum Polyjet-Druckmodul). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Bei der Herstellung des mehrschichtigen Phantoms ist das für die Spinbeschichtung verwendete Material eine Art lichthärtendes Material anstelle von PDMS. Die Zwischenschicht wird mit dem Polyjet-Druckverfahren gedruckt, bei dem das lichthärtende Harz als Rohstoff verwendet wird. Obwohl dünne PDMS-Phantome nach Zugabe von Tert-Butyl-Alkohol durch Spin-Beschichtung hergestellt werden können, kann eine PDMS-Schicht beim Polyjet-Druck nicht effektiv an das lichthärtende Material binden. Deshalb haben wir uns für das l…
Declarações
The authors have nothing to disclose.
Acknowledgements
Die Arbeit wurde von der National Natural Science Foundation of China (Grant Nos. 11002139 und 81327803) und den Fundamental Research Funds for the Central Universities unterstützt. Wir danken Zachary J. Smith von der University of Science and Technology für die Audio-Voiceover.
Materials
| 2-Hydroxy-2-methylpropiophenone | aladdin | H110280-500g | Light initiator http://www.aladdin-e.com/ |
| 3D printing control system | USTC | USTC-3DPrinter_control1.0 | custom-made github: https://github.com/macanzhen/ |
| 3D printing system | USTC | USTC-3DPrinter1.0 | custom-made |
| AcroRip color | Human Plus | AcroRip v8.2.6 | |
| All-in-one nozzle slicing script | Shenzhen CBD Technology Co.,Ltd. | github: https://github.com/macanzhen/ |
|
| Chinese Red Dye | Juents | Oil-soluble | |
| Cura | Ultimaker | Cura_15.04.6 | |
| Gel Wax | Shanghai Lida Industry Co.,ltd. | LP | melting point: 56 °C |
| Graphite | aladdin | G103922-100g | Change object optical absorption parameters http://www.aladdin-e.com/ |
| PDMS | Dow Corning | 184 | |
| Titanium dioxide | ALDRICH | 24858-100G | 347 nm |
| Triethylene glycol dimethacrylate | aladdin | T101642-250ml | Photocured monomer http://www.aladdin-e.com/ |
| UV ink SLA Photopolymer Resin | time80s | RESIN-A | http://www.time80s.com/zlxz |
Referências
- Lu, G., Fei, B. Medical hyperspectral imaging: a review. Journal of Biomedical Optics. 19 (1), 010901 (2014).
- Wang, K., et al. Development of a non-uniform discrete Fourier transform based high speed spectral domain optical coherence tomography system. Optics Express. 17 (14), 12121-12131 (2009).
- Zhao, H., Gao, F., Tanikawa, Y., Homma, K., Yamada, Y. Time-resolved diffuse optical tomographic imaging for the provision of both anatomical and functional information about biological tissue. Applied Optics. 44 (10), 1905-1916 (2005).
- Ding, Z., Ren, H., Zhao, Y., Nelson, J. S., Chen, Z. High-resolution optical coherence tomography over a large depth range with an axicon lens. Optics Letters. 27 (4), 243-245 (2002).
- Iida, H., et al. Three-dimensional brain phantom containing bone and grey matter structures with a realistic head contour. Annals of Nuclear Medicine. 27 (1), 25-36 (2013).
- Mobashsher, A. T., Abbosh, A. Three-dimensional human head phantom with realistic electrical properties and anatomy. IEEE Antennas and Wireless Propagation Letters. 13, 1401-1404 (2014).
- Li, J. B., et al. A new head phantom with realistic shape and spatially varying skull resistivity distribution. IEEE Transactions on Biomedical Engineering. 61 (2), 254-263 (2013).
- Bykov, A., et al. Multilayer tissue phantoms with embedded capillary system for OCT and DOCT imaging. Life Sciences. (International Society for Optics and Photonics). , 73760 (2011).
- Bykov, A. V., Popov, A. P., Priezzhev, A. V., Myllylä, R. Skin phantoms with realistic vessel structure for OCT measurements in Laser Applications. European Conference on Biomedical Optics. , 80911 (2010).
- Park, J., et al. Fabrication of double layer optical tissue phantom by spin coating method: mimicking epidermal and dermal layer. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue V. , 85830 (2013).
- Wróbel, M. S., et al. Use of optical skin phantoms for preclinical evaluation of laser efficiency for skin lesion therapy. Journal of Biomedical Optics. 20 (8), 085003 (2015).
- Sheng, S., Wu, Q., Han, Y., Dong, E., Xu, R. Fabricating optical phantoms to simulate skin tissue properties and microvasculature. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue Vii. , 932507 (2015).
- Lurie, K. L., Smith, G. T., Khan, S. A., Liao, J. C., Ellerbee, A. K. Three-dimensional, distendable bladder phantom for optical coherence tomography and white light cystoscopy. Journal of Biomedical Optics. 19 (3), 36009 (2014).
- Hahn, C., Noghanian, S. Heterogeneous breast phantom development for microwave imaging using regression models. Journal of Biomedical Imaging. 2012, 6 (2012).
- Ansari, M. A., Mohajerani, E. Estimation of optical abnormalities in breast phantom by diffuse equation. Optik-International Journal for Light and Electron Optics. 125 (20), 5978-5981 (2014).
- Roman, M., Gonzalez, J., Carrasquilla, J., Erickson, S. J., Godavarty, A. A Gen-2 Hand-Held Optical Imager: Phantom and Preliminary in-vivo Breast Imaging Studies. 29th Southern Biomedical Engineering Conference. , 103-104 (2013).
- Michaelsen, K. E., et al. Anthropomorphic breast phantoms with physiological water, lipid, and hemoglobin content for near-infrared spectral tomography. Journal of Biomedical Optics. 19 (2), 026012 (2014).
- Park, J., et al. Optical tissue phantoms based on spin coating method. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue VII. , 93250 (2015).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. Journal of Visualized Experiments. (138), e57578 (2018).
- Luciano, N. J., et al. Utilizing 3D printing technology to merge MRI with histology: A protocol for brain sectioning. Journal of Visualized Experiments. (118), e54780 (2016).
- Dong, E., et al. Three-dimensional fuse deposition modeling of tissue-simulating phantom for biomedical optical imaging. Journal of Biomedical Optics. 20 (12), 121311 (2015).
- Beltrame, E. D. V., et al. 3D Printing of Biomolecular Models for Research and Pedagogy. Journal of Visualized Experiments. (121), e55427 (2017).
- Bentz, B. Z., Chavan, A. V., Lin, D., Tsai, E. H., Webb, K. J. Fabrication and application of heterogeneous printed mouse phantoms for whole animal optical imaging. Applied Optics. 55 (2), 280-287 (2016).
- Liu, G., et al. Fabrication of a multilayer tissue-mimicking phantom with tunable optical properties to simulate vascular oxygenation and perfusion for optical imaging technology. Applied Optics. 57 (23), 6772-6780 (2018).

