Probenvorbereitung in Quarzkristall-Mikrobilanzmessungen der Proteinadsorption und Polymermechanik
Summary
Die Quarzkristall-Mikrobalance kann genaue Massen- und viskoelastische Eigenschaften für Filme im Mikron- oder Submikron-Bereich bieten, was für Untersuchungen in der biomedizinischen und Umweltsensorik, Beschichtungen und Polymerwissenschaft relevant ist. Die Probendicke beeinflusst, welche Informationen aus dem Material gewonnen werden können, das mit dem Sensor in Berührung gelangt.
Abstract
In dieser Studie stellen wir verschiedene Beispiele dar, wie dünnschichtliche Präparation für Quarzkristall-Mikrobalance-Experimente die entsprechende Modellierung der Daten informiert und bestimmt, welche Eigenschaften des Films quantifiziert werden können. Die Quarzkristall-Mikrobalance bietet eine einzigartig empfindliche Plattform zur Messung feiner Massen- und/oder mechanischer Eigenschaften einer aufgebrachten Folie, indem sie die Veränderungen der mechanischen Resonanz eines bei hoher Frequenz oszillierenden Quarzkristalls beobachtet. Zu den Vorteilen dieses Ansatzes gehören seine experimentelle Vielseitigkeit, die Fähigkeit, Veränderungen der Eigenschaften über eine Vielzahl experimenteller Zeitlängen zu untersuchen, und die Verwendung kleiner Probengrößen. Wir zeigen, dass wir auf der Grundlage der Dicke und des Schermoduls der auf dem Sensor abgelagerten Schicht unterschiedliche Informationen aus dem Material gewinnen können. Hierbei wird dieses Konzept gezielt genutzt, um experimentelle Parameter darzustellen, die zu massen- und viskoelastischen Berechnungen von adsorbiertem Kollagen auf Gold- und Polyelektrolytkomplexen während der Schwellung in Abhängigkeit von der Salzkonzentration führen.
Introduction
Das Quarzkristall-Mikrogleichgewicht (QCM) nutzt die piezoelektrische Wirkung eines Quarzkristalls, um seine Resonanzfrequenz zu überwachen, die von der an der Oberfläche haftenden Masse abhängt. Die Technik vergleicht die Resonanzfrequenz und Bandbreite eines AT-geschnittenen Quarzkristallsensors (typischerweise im Bereich von 5 MHz)1 in Luft oder Flüssigkeit mit der Frequenz und Bandbreite des Sensors nach Abscheidung eines Films. Es gibt mehrere Vorteile für die Verwendung des QCM, um Dünnschichteigenschaften und Schnittstellen zu untersuchen, einschließlich der hohen Empfindlichkeit gegenüber Masse und potenziell viskoelastischen Eigenschaftsänderungen (abhängig von Probengleichmäßigkeit und Dicke), der Fähigkeit, Studien in situ2durchzuführen, und der Fähigkeit, eine viel kürzere rheologische Zeitskala als herkömmliche Scherrheologie oder dynamische mechanische Analyse (DMA) zu untersuchen. Die Untersuchung einer kurzen rheologischen Zeitskala ermöglicht die Beobachtung, wie sich die Reaktion in dieser Zeitskala sowohl über extrem kurze (ms)3 als auch über lange (Jahre) Dauern4ändert. Diese Fähigkeit ist vorteilhaft für die Untersuchung einer Vielzahl von kinetischen Prozessen und ist auch eine nützliche Erweiterung der traditionellen rheometrischen Techniken5,6.
Die hohe Empfindlichkeit des QCM hat auch zu seinem starken Einsatz in biologischen Anwendungen geführt, die die grundlegenden Wechselwirkungen extrem kleiner Biomoleküle untersuchen. Eine unbeschichtete oder funktionalisierte Sensoroberfläche kann verwendet werden, um die Proteinadsorption zu untersuchen; noch weiter kann die Biosensing durch komplexe Bindungsereignisse zwischen Enzymen, Antikörpern und Aptamern anhand von Veränderungen in Masse7,8,9untersucht werden. Zum Beispiel wurde die Technik verwendet, um die Umwandlung von Vesikeln zu einer planaren Lipid-Bilayer als zweiphasigen Prozess der Adsorption von flüssigkeitshaltigen Vesikeln zu einer starren Struktur zu verstehen, indem korrelierende Veränderungen in Frequenz und Viskoelastizität beobachtet werden10. In den letzten Jahren hat das QCM zusätzlich eine robuste Plattform zur Überwachung der Arzneimittelabgabe durch Vesikel oder Nanopartikel11angeboten. An der Schnittstelle von Materialtechnik und Molekular- und Zellbiologie können wir das QCM verwenden, um wichtige Wechselwirkungen zwischen Materialien und bioaktiven Komponenten wie Proteinen, Nukleinsäuren, Liposomen und Zellen aufzuklären. Zum Beispiel vermittelt die Proteinadsorption an ein Biomaterial nachgeschaltete zelluläre Reaktionen wie Entzündungen und wird oft als positiver Indikator für Biokompatibilität verwendet, während in anderen Fällen die extrazelluläre Proteinanhaftung an Beschichtungen, die mit Blut inGrenze stehen, gefährliche Gerinnung in den Gefäßen12,13induzieren könnte. Das QCM kann daher als Werkzeug zur Auswahl von Kandidaten verwendet werden, die optimal für unterschiedliche Bedürfnisse sind.
Zwei gängige Ansätze für die Durchführung von QCM-Experimenten sammeln analoge Daten aus dem Experiment: Der erste Ansatz zeichnet die Frequenzverschiebung und die halbe Bandbreite ()des Leitfähigkeitsspitzen auf. Der zweite Ansatz, QCM mit Ableitung (QCM-D), zeichnet die Frequenzverschiebung und den Ableitungsfaktor auf, der durch Gleichung 1, 14 direkt proportional zu Gleichung 1,14 ist.
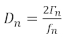 (1)
(1)
wobei D der Ableitungsfaktor ist und die Frequenz . Sowohl D als auch B beziehen sich auf die Dämpfungswirkung des Films auf den Sensor, was auf die Steifigkeit des Films hinweist. Das Subskript ist der Frequenzoberton oder die Oberschwingung, d.h. die ungeraden Resonanzfrequenzen des Quarzsensors (n = 1, 3, 5, 7…). Weitere Diskussionen über Modelle mit mehreren Oberschwingungen, um die masse- und viskoelastischen Eigenschaften eines Films zu erhalten, finden Sie in einer Rezension von Johannsmann14 und früheren Arbeiten der Shull-Gruppe15,16,17,18.
Ein wichtiger Aspekt bei der Vorbereitung von QCM-Proben ist die Anwendung des Dünnfilms auf die Sensoroberfläche. Einige gängige Methoden sind Spin-Beschichtung, Dip-Beschichtung, Tropfenbeschichtung oder Adsorption des Films auf die Sensoroberfläche während des Experiments19,20. Es gibt vier Regionen für QCM-Proben: die Sauerbrey-Grenze, das viskoelastische Regime, das Massenregime und das überdämpfte Regime. Für ausreichend dünne Folien gilt die Sauerbrey-Grenze, bei der die Frequenzverschiebung(B)die Oberflächenmassendichte des Films liefert. Innerhalb der Sauerbrey-Grenze sind die Frequenzverschiebungssskalen linear mit der Resonanzharmonischen, n, und Veränderungen des Dämpfungsfaktors (D oder B) sind im Allgemeinen klein. In diesem Regime sind keine ausreichenden Informationen verfügbar, um die rheologischen Eigenschaften der Schicht eindeutig zu bestimmen, ohne zusätzliche Annahmen zu treffen. Daten in diesem Regime werden verwendet, um die Oberflächenmassendichte (oder Dicke, wenn die Dichte a prioribekannt ist) des Films zu berechnen. In dem Massenregime, bei dem das mit dem Kristall in Berührung gebrachte Medium ausreichend dick ist, breitet sich die vermehrte Scherwelle in das Medium aus, bevor sie vollständig gedämpft wird. Hier können keine Masseninformationen mit dem Wert . In diesem Bereich werden jedoch die viskoelastischen Eigenschaften zuverlässig durch die Kombination von . Wenn das Medium zu starr ist, dämpft der Film die Resonanz des Sensors und verhindert so die Erfassung zuverlässiger Daten aus dem QCM. Das viskoelastische Regime ist das Zwischenregime, bei dem der Film dünn genug ist, um die Scherwelle vollständig durch den Film zu verbreiten und zuverlässige Werte für den Dämpfungsfaktor zu haben. Der Dämpfungsfaktor und die –können dann verwendet werden, um die viskoelastischen Eigenschaften des Films sowie seine Masse zu bestimmen. Hier beidiesem werden die viskoelastischen Eigenschaften durch das Produkt der Dichte und der Größe des komplexen Schermoduls gegeben | G*| p und den Phasenwinkel, der durch die Linie ” = arctan(G” / G’angegeben wird. Wenn Filme im Sauerbrey-Grenzwert vorbereitet werden, kann die Masse pro Flächeneinheit direkt auf der Grundlage der unter21dargestellten Sauerbrey-Gleichung berechnet werden.
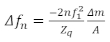 (2)
(2)
wobei n die Änderung der Resonanzfrequenzist, n der Oberton des Interesses, n1 die Resonanzfrequenz des Sensors, m/Adie Masse pro Filmbereich und Zq die akustische Impedanz von Quarz, die für AT geschnittenen Quarz Z q= 8,84 x 106kg / m2s ist. Das viskoelastische Regime eignet sich am besten für die Untersuchung von Polymerfolien, und die Massengrenze ist nützlich für die Untersuchung von viskosen Polymer22 oder Proteinlösungen16. Die verschiedenen Regime hängen von den Eigenschaften des Materials von Interesse ab, wobei die optimale Dicke für volle viskoelastische und Massencharakterisierung in der Regel mit der Filmsteifigkeit zunimmt. Abbildung 1 beschreibt die vier Bereiche in Bezug auf die Arealdichte des Films, den komplexen Schermodul und den Phasenwinkel, wobei wir eine spezifische Beziehung zwischen dem Phasenwinkel und der Filmsteifigkeit angenommen haben, die sich als relevant für Materialien dieser Art erwiesen hat. Viele Filme von praktischem Interesse sind zu dick, um die viskoelastischen Eigenschaften mit QCM zu untersuchen, wie z. B. bestimmte Biofilme, bei denen die Dicken in der Größenordnung von Zehner bis Hunderten von Mikrometern23liegen. Solche dicken Folien eignen sich in der Regel nicht für die Untersuchung mit dem QCM, können aber mit viel niedrigeren Frequenzresonatoren (wie Torsonatoren)23gemessen werden, so dass sich die Scherwelle weiter in den Film ausbreiten kann.
Um zu bestimmen, welches Regime für eine bestimmte QCM-Probe relevant ist, ist es wichtig, denParameter d / n zu verstehen, d. n. Parameter, d. H. das Verhältnis der Filmdicke (d) zur Scherwellenlänge der mechanischen Schwingung des Quarzkristallsensors(n)15,16,18. Das ideale viskoelastische Regime ist d /n = 0,05 – 0,218, wobei Werte unter 0,05 innerhalb der Sauerbrey-Grenze liegen und Werte über 0,2 dem Bulk-Regime näher kommen. Eine strengere Beschreibung von d /n ist an anderer Stelle15,18, aber es ist ein quantitativer Parameter, der die Sauerbrey-Grenze und die viskoelastische Grenze ablegt. Die unten verwendeten Analyseprogramme stellen diesen Parameter direkt bereit.
Es gibt einige zusätzliche Einschränkungen bei der Analyse von Dünnschichten mit dem QCM. Die Berechnungen von Sauerbrey und viskoelastischen Berechnungen gehen davon aus, dass der Film sowohl während der gesamten Filmdicke als auch seitlich über die Elektrodenoberfläche des QCM homogen ist. Während diese Annahme es schwierig macht, Filme zu untersuchen, die Hohlräume oder Füllstoffe vorhanden haben, gab es einige QCM-Untersuchungen zu Filmen, die aus transplantierten Nanopartikeln bestehen6. Sind die Heterogenitäten im Vergleich zur Gesamtschichtdicke gering, können zuverlässige viskoelastische Eigenschaften des Verbundsystems erhalten werden. Bei heterogeneren Systemen sollten Werte, die aus einer viskoelastischen Analyse gewonnen werden, immer mit großer Vorsicht betrachtet werden. Idealerweise sollten Ergebnisse aus Systemen mit unbekannter Heterogenität anhand von Systemen validiert werden, von denen bekannt ist, dass sie homogen sind. Dies ist der Ansatz, den wir in dem in diesem Papier beschriebenen Beispielsystem verfolgt haben.
Ein wichtiger Punkt, den wir in diesem Papier veranschaulichen, ist die genaue Übereinstimmung zwischen QCM-Messungen, die im Frequenzbereich durchgeführt werden (wo die S berichtet wird) und den Zeitbereichsexperimenten (wobei D gemeldet wird). Die Ergebnisse von zwei verschiedenen QCM-Experimenten, einer Zeitdomäne und einer Frequenzdomäne, werden beschrieben, die jeweils ein anderes, aber konzeptionell verwandtes Modellsystem beinhalten. Das erste System ist ein einfaches Beispiel für die Kollagenbefestigung am Sensor, um die repräsentative Bindungskinetik und das Gleichgewicht der Adsorption im Laufe der Zeit während einer Zeitbereichsmessung (QCM-D) zu veranschaulichen. Kollagen ist das am häufigsten vorkommende Protein im Körper, bekannt für seine Vielseitigkeit von Bindungsverhalten und Morphologie. Die hier verwendete Kollagenlösung erfordert keine zusätzliche Funktionalisierung der Goldoberfläche des Sensors, um Adsorption9zu induzieren. Das zweite experimentelle System ist ein Polyelektrolytkomplex (PEC), der aus anionischem Polystyrolsulfonat (PSS) und kationischem Poly(Diallyldimethylammonium) (PDADMA) besteht, der auf die gleiche Weise wie Sadman et al.22hergestellt wird. Diese Materialien schwellen an und werden weich in Salz (in diesem Fall KBr) Lösungen, bietet eine einfache Plattform für das Studium der Polymermechanik mit einem Frequenzbereichsansatz (QCM-Z). Für jedes Protokoll ist der Prozess der Vorbereitung, Aufnahme und Analyse einer Messung in Abbildung 2dargestellt. Das Schema zeigt, dass der Hauptunterschied zwischen den QCM-Z- und QCM-D-Ansätzen im Datenerfassungsschritt und der im Experiment verwendeten Instrumentierung liegt. Alle genannten Probenvorbereitungstechniken sind mit beiden Ansätzen kompatibel, und jeder Ansatz kann Proben in den drei in Abbildung 1dargestellten Bereichen analysieren.
Unsere Daten zeigen, dass die Herstellung von Proben, sei es durch Sensorbeschichtung vor oder während einer Messung, die Fähigkeit vorschreibt, die viskoelastischen Eigenschaften eines Systems zu extrahieren. Indem wir die frühen Phasen eines Experiments entsprechend gestalten, können wir bestimmen, welche Informationen wir während des Analyseschritts genau erfassen können.
Protocol
Representative Results
Discussion
Die Kollagenadsorptionsergebnisse erstrecken sich über die Sauerbrey- und viskoelastischen Regime. Durch die Darstellung der auf die entsprechende oberharmonische Zahl normalisierten Frequenzverschiebungen stellen wir fest, dass die Sauerbrey-Grenze für ungefähr die ersten 2 h der Messung gilt. Mit zunehmender Masse, die am Sensor festhält, beginnen jedoch die normalisierten Frequenzverschiebungen für die dritte und fünfte Oberschwingung voneinander abzuweichen(t > 2 h), was auf die Fähigkeit hindeutet, v…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde von der NSF (DMR-1710491, OISE-1743748) unterstützt. J.R. und E.S. bestätigen die Unterstützung durch die NSF (DMR-1751308).
Materials
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
Referências
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution – Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists’ paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).

