使用延时荧光显微镜对细菌捕食者 Bdellovibrio 细菌的生命周期进行活细胞成像
Summary
此处介绍的是一个协议,它描述了使用延时荧光显微镜与 agarose 垫和细胞成像盘相结合的掠夺性细菌 Bdellovibrio 细菌的完整生命周期的监测。
Abstract
Bdellovibrio 细菌是一 种小克阴性,强制性掠夺性细菌,可以杀死其他克阴性细菌,包括有害的病原体。因此,它被认为是一种活的抗生素。为了 将B.细菌作为一种 活抗生素,首先需要了解其复杂生命周期的主要阶段,特别是其在猎物体内的增殖。到目前为止,实时监控掠夺性生命周期的连续阶段一直具有挑战性。这里介绍的是一个全面的协议,用于 实时成像B.细菌的整个生命周期,特别是在它生长在宿主体内。为此,一个由阿加罗斯垫组成的系统与细胞成像盘结合使用,其中掠夺性细胞可以在阿加罗斯垫下自由移动,而固定猎物细胞能够形成白细胞。产生荧光标记的β-亚基的DNA聚合酶III的菌株的应用进一步允许在 B.细菌生命周期 的繁殖阶段监测染色体复制。
Introduction
Bdellovibrio细菌是一种小(0.3±0.5μm ×0.5±1.4μm)克阴性细菌,可捕食其他克阴性细菌,包括有害的病原体,如肺炎克勒布西拉、伪多莫纳斯aeruginosa和Shigella弹性神经1,2,3。2,3由于B.细菌杀死病原体,它被认为是一种潜在的活抗生素,可以用于对抗细菌感染,特别是那些由耐多药菌株引起的细菌感染。
B. 细菌具有一个奇特的生命周期,由两个阶段组成:自由生命的非复制性攻击阶段和细胞内生殖阶段(图1)。在自由生活阶段,这种高度移动的细菌,其移动速度高达160μm/s,搜索其猎物。附着在猎物的外膜上后,它进入4,5的内膜5。在白细胞间生殖阶段,B.细菌使用大量的水解酶来降解宿主的大分子,并重复使用它们以促进自身的生长。在入侵腹膜后不久,宿主细胞死亡并膨胀成一个球形结构,称为bdelloplast,其中掠夺性细胞拉长并复制其染色体。复制过程从复制源(oriC)6开始,一直持续到染色体的几个副本被完全合成7。有趣的是,每个染色体的复制后面不跟随细胞分裂。相反,捕食者拉长形成一个长,多核和丝状细胞。当营养枯竭时,灯丝经过同步隔膜,后代细胞从bdelloplast8中释放。
在B.细菌可以用作对抗细菌感染的活抗生素之前,了解其生命周期的主要阶段,特别是与猎物内增殖有关的阶段至关重要。由于在复杂的生命周期中,由于捕食者及其猎物的各种形态形式,B.细菌的活细胞成像一直具有挑战性。到目前为止,B.细菌与其宿主细胞之间的相互作用主要通过电子显微镜和,捕捉分析2、9、10进行了研究,9这两者都有局限性,特别是当它们被用来监测掠食性生命周期的连续阶段时。10这些方法提供B.细菌细胞的高分辨率图像,并使我们能够在攻击或生长阶段观察一个小捕食者。然而,它们不允许在两个生命周期阶段跟踪单个B.细菌。
这里介绍的是一个全面的协议,使用延时荧光显微镜(TLFM)来监测B.细菌的整个生命周期。由阿加罗斯垫组成的系统与细胞成像盘结合使用,其中掠夺性细胞可以在阿加罗斯垫下自由移动,而固定化的猎物细胞能够形成白杨拉斯特(图2)。此设置是根据大肠杆菌和B.细菌的特定菌株准备的E. coli,但协议可以很容易地改变,以适应用户的个人菌株(例如,携带不同的选择标记,蛋白质与不同的荧光团融合,等等)。
在这种情况下,为了在攻击 阶段可视化B.细菌 ,构建了一种特定的菌株(HD100 DnaN-mNeonGreen/PilZ-mCherry),它表达了细胞质蛋白的荧光标记版本,PilZ(可应要求在我们的实验室中提供)7。该菌株还产生DnaN(+滑动夹),DNA聚合酶III全息酶的亚基,与荧光蛋白融合。这使得正在进行的DNA复制在掠食性细胞内被监测,因为它们在bdelloplast中生长。
虽然所述用于图像采集的协议和软件是指特定制造商提供的倒置显微镜(参见材料 表),但该技术可针对任何配备环境室或其他外部加热支架且能够延时成像的倒置显微镜进行调整。对于数据分析,用户可以选择与单个输出格式兼容的任何可用软件。
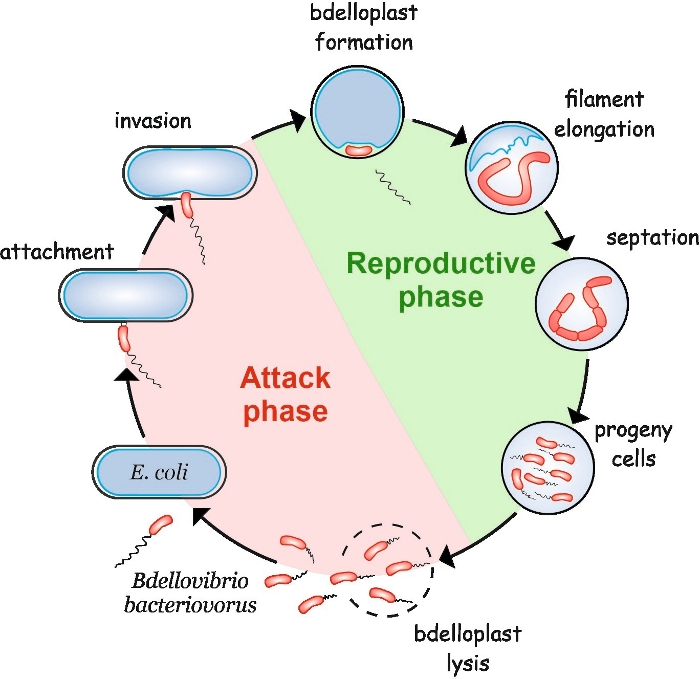
图1: 大肠杆菌作为宿主 细胞的B. 细菌 生命周期。在攻击阶段,自由游 的B.细菌沃鲁斯 细胞搜索并附着在宿主 大肠杆菌细胞上 。入侵后,掠食性细胞在猎物的周围质中变得局部化,改变宿主细胞的形状,形成一个卵母细胞。生殖阶段从 bdelloplast 形成开始。掠夺性细胞消化猎物细胞,并重复使用简单的化合物来构建自己的结构。 B. 细菌作为 长丝生长在宿主的内皮。当猎物细胞的资源耗尽时 ,B.细菌丝 同步分裂并形成后代细胞。后代细胞发育后,它们就使白细胞发育成白细胞。 请单击此处查看此图的较大版本。
Protocol
Representative Results
Discussion
由于人们越来越有兴趣使用 B.细菌 作为活抗生素,因此需要新的工具来观察掠夺性生命周期,特别是捕食者-病原体相互作用。所提出的协议用于实时跟踪整个 B.细菌 生命周期,特别是在宿主内部生长过程中。此外,利用一种产生荧光标记β夹的DNA聚合酶III全息酶的菌株的应用,能够监测染色体复制进展在整个 B.细菌的繁殖阶段。
此方法的关键步骤是正确…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项研究得到了国家科学中心授予Opus 2018/29/B/NZ6/00539给J.Z.C的支持。
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Referências
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

