Live-Cell Imaging af livscyklus bakteriel Predator Bdellovibrio bacteriovorus ved hjælp af Time-Lapse Fluorescens mikroskopi
Summary
Præsenteret her er en protokol, der beskriver overvågning af hele livscyklus aggressiv bakterie Bdellovibrio bakterien ved hjælp af time-lapse fluorescens mikroskopi i kombination med en agarose pad og celle-imaging retter.
Abstract
Bdellovibrio bacteriovorus er en lille gram-negativ, forpligte aggressiv bakterie, der dræber andre gram-negative bakterier, herunder skadelige patogener. Derfor er det betragtes som et levende antibiotikum. At anvende B. bacteriovorus som et levende antibiotikum, er det først nødvendigt at forstå de store faser af sin komplekse livscyklus, især dens spredning inde bytte. Hidtil har det været udfordrende at overvåge på hinanden følgende stadier af aggressiv livscyklus i realtid. Præsenteret her er en omfattende protokol for real-time billeddannelse af hele livscyklus B. bacteriovorus, især under sin vækst inde i værten. Til dette formål anvendes et system bestående af en agarosepude i kombination med cellebilleddannelsesretter, hvor de rovfugleceller kan bevæge sig frit under agarosepuden, mens immobiliserede bytteceller er i stand til at danne bdelloplasts. Anvendelsen af en stamme, der frembliker en fluorescerende mærket β-underenhed af DNA polymerase III yderligere gør det muligt kromosom replikation, der skal overvåges i reproduktionsfasen af B. bakteriens livscyklus.
Introduction
Bdellovibrio bacteriovorus er en lille (0,3-0,5 μm med 0,5-1,4 μm) gram-negativ bakterie, der udnytter andre gram-negative bakterier, herunder skadelige patogener såsom Klebsiella pneumoniae, Pseudomonas aeruginosa, og Shigella flexneri1,2,3. Da B. bacteriovorus dræber patogener, det betragtes som en potentiel levende antibiotikum, der kan anvendes til bekæmpelse af bakterielle infektioner, især dem forårsaget af multiresistente stammer.
B. bacteriovorus udviser en ejendommelig livscyklus bestående af to faser: en fritlevende ikke-replikeret angrebsfase og en intracellulær forplantningsfase (Figur 1). I den fritlevende fase søger denne meget motile bakterie, som bevæger sig med hastigheder på op til 160 μm/s, efter sit bytte. Efter fastgørelse til byttets ydre membran kommer den ind i periplasmen4,5. I den interperiplasmiske forplantningsfase bruger B. bacteriovorus et væld af hydrolytiske enzymer til at nedbryde værtens makromolekyler og genbruge dem til sin egen vækst. Kort efter at invadere periplasma, værtscellen dør og oppustethed i en sfærisk struktur kaldet en bdelloplast, inden for hvilken den aggressiv celle forlænger og replikerer sine kromosomer. Replikeringsprocessen starter ved replikeringsstarten (oriC)6 og fortsætter, indtil flere kopier af kromosomet er blevet fuldstændig syntetiseret7. Interessant, replikation af hvert kromosom er ikke efterfulgt af celledeling. I stedet rovdyrlanger til at danne en lang, multinucleoid og filamentous celle. Ved næringsstofudtynding gennemgår glødetråden synkron septation, og afkomceller frigives fra bdelloplast8.
Før B. bacteriovorus kan bruges som et levende antibiotikum mod bakterielle infektioner, er det afgørende at forstå de store faser af sin livscyklus, især dem, der vedrører dens spredning inde i byttet. Live-celle billeddannelse af B. bacteriovorus har været udfordrende, på grund af de forskellige morfologiske former for rovdyr og dets bytte i den komplekse livscyklus. Hidtil har samspillet mellem B. bacteriovorus og dens værtscelle er hovedsageligt blevet undersøgt ved elektronmikroskopi og snap-shot analyse2,9,10, som begge har begrænsninger, især når de bruges til at overvåge på hinanden følgende stadier af aggressiv livscyklus. Disse metoder giver billeder i høj opløsning af B. bacteriovorus celler og muliggøre observation af et lille rovdyr under angrebet eller vækstfasen. Men, de tillader ikke sporing af enkelt B. bakteriovorus celler i begge livscyklus faser.
Præsenteret her er en omfattende protokol for brug af time-lapse fluorescens mikroskopi (TLFM) til at overvåge hele livscyklus B. bacteriovorus. Et system bestående af en agarosepude anvendes i kombination med en cellebilledskål, hvor de rovfugleceller kan bevæge sig frit under agarosepuden, mens de immobiliserede bytteceller er i stand til at danne bdelloplasts (Figur 2). Denne opsætning er udarbejdet på grundlag af specifikke stammer af både E. coli og B. bacteriovorus, men protokollen kan let ændres, så den passer til en brugers individuelle stammer (f.eks med forskellige udvælgelsesmarkører, proteiner sammensmeltet med forskellige fluorophores osv.).
I dette tilfælde, at visualisere B. bacteriovorus under angrebet fase, en bestemt stamme (HD100 DnaN-mNeonGreen/PilZ-mCherry) blev konstrueret, der udtrykker en fluorescerende mærket version af cytoplasmatisk protein, PilZ (tilgængelig i vores laboratorium efter anmodning)7. Denne stamme desuden producerer DnaN (β-glidende klemme), en underenhed af DNA polymerase III holoenzym, fusioneret med en fluorescerende protein. Dette gør det muligt løbende DNA replikation, der skal overvåges inde i aggressiv celler, som de vokser inden for bdelloplasts.
Selv om den beskrevne protokol og software, der anvendes til billederhvervelse, henviser til et omvendt mikroskop fra en bestemt producent (se Tabelover Materialer), kan denne teknik justeres for ethvert omvendt mikroskop, der er udstyret med et miljøkammer eller en anden ekstern varmeholder, og som kan foretage time-lapse-billeddannelse. Til dataanalyse kan brugerne vælge tilgængelig software, der er kompatibel med de enkelte outputformater.
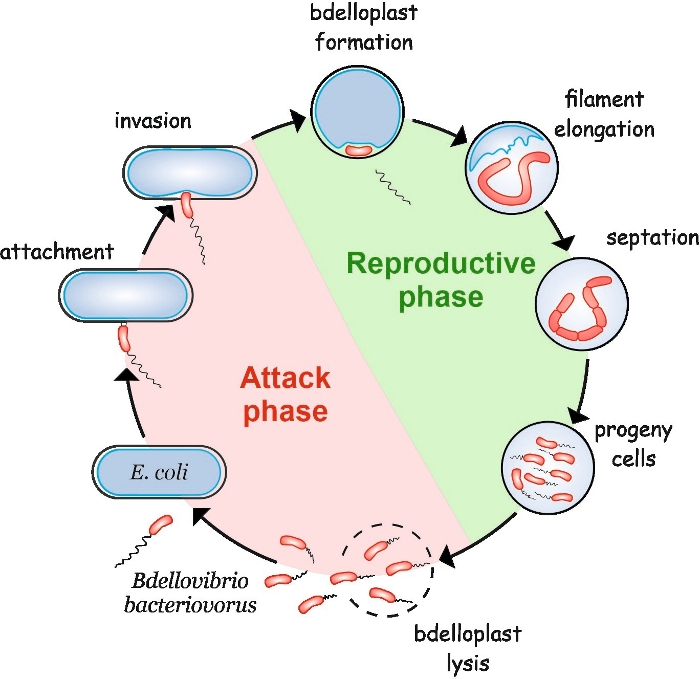
Figur 1: B. bacteriovorus livscyklus i E. coli som værtscelle. Under angrebet fase, en fri-svømning B. bacteriovorus celle søger efter og tillægger en vært E. coli celle. Efter invasionen bliver den rovcelle lokaliseret i byttets periplasme, hvilket ændrer værtscellens form og danner en bdelloplast. Den reproduktive fase starter med bdelloplast dannelse. Den aggressiv celle fordøjer byttecellen og genbruger simple forbindelser til at bygge sine egne strukturer. B. bacteriovorus vokser som en lang enkelt glødetråd inde i værtens periplasm. Når byttecellens ressourcer er opbrugt, b. bakterienus glødetråd synkront septater og danner afkom celler. Efter afkomceller udvikle deres flagella, de lyse bdelloplast. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
På grund af den øgede interesse i at bruge B. bacteriovorus som et levende antibiotikum, nye værktøjer til at observere aggressiv livscyklus, især rovdyr-patogen interaktioner, er nødvendige. Den præsenterede protokol bruges til at spore hele B. bakteriens livscyklus, især under sin vækst inde i værten, i realtid. Desuden, anvendelse af en stamme, der producerer fluorescerende mærket beta klemme af DNA polymerase III holoenzyme aktiveret overvågning af kromosom replikation progression i hele…
Declarações
The authors have nothing to disclose.
Acknowledgements
Denne undersøgelse blev støttet af National Science Centre grant Opus 2018/29/B/NZ6/00539 til J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Referências
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

