Imagerie à cellules vivantes du cycle de vie du prédateur bactérien Bdellovibrio bactériovore à l’aide de la microscopie par fluorescence time-lapse
Summary
Présenté ici est un protocole qui décrit la surveillance du cycle de vie complet de la bactérie prédatrice Bdellovibrio bactériovorus en utilisant la microscopie de fluorescence time-lapse en combinaison avec un tampon agarose et des plats d’imagerie cellulaire.
Abstract
Bdellovibrio bactériovorus est une petite bactérie prédatrice gramme-négative et obligatoire qui tue d’autres bactéries gramnégatives, y compris les pathogènes nocifs. Par conséquent, il est considéré comme un antibiotique vivant. Pour appliquer B. bactériovorus comme antibiotique vivant, il est d’abord nécessaire de comprendre les grandes étapes de son cycle de vie complexe, en particulier sa prolifération à l’intérieur des proies. Jusqu’à présent, il a été difficile de surveiller les étapes successives du cycle de vie prédateur en temps réel. Présenté ici est un protocole complet pour l’imagerie en temps réel du cycle de vie complet de B. bactériovorus, en particulier lors de sa croissance à l’intérieur de l’hôte. À cette fin, un système composé d’un tampon d’agarose est utilisé en combinaison avec des plats d’imagerie cellulaire, dans lequel les cellules prédatrices peuvent se déplacer librement sous le tampon agarose tandis que les cellules de proies immobilisées sont capables de former des bdelloplastes. L’application d’une souche produisant une sous-unité β-marquée fluorescente de la polymérase III permet de surveiller davantage la réplication chromosomique pendant la phase de reproduction du cycle de vie de B. bacteriovorus.
Introduction
Bdellovibrio bactériovorus est une petite bactérie gram-négative (0,3–0,5 μm par 0,5–1,4 μm) qui s’attaque à d’autres bactéries gramnégatives, y compris les pathogènes nocifs tels que Klebsiella pneumoniae, Pseudomonas aeruginosa et Shigella flexneri1,2,3. Étant donné que B. bactériovorus tue les agents pathogènes, il est considéré comme un antibiotique vivant potentiel qui peut être appliqué pour lutter contre les infections bactériennes, en particulier celles causées par des souches multirésistantes.
B. bactériovorus présente un cycle de vie particulier composé de deux phases : une phase d’attaque non réplicative à vie libre et une phase de reproduction intracellulaire (figure 1). Dans la phase de libre-vie, cette bactérie très motile, qui se déplace à des vitesses allant jusqu’à 160 μm/s, recherche sa proie. Après s’être attaché à la membrane externe de la proie, il pénètre dans le périplasme4,5. Pendant la phase de reproduction interpériplasmique, B. bactériovorus utilise une pléthore d’enzymes hydrolytiques pour dégrader les macromolécules de l’hôte et les réutiliser pour sa propre croissance. Peu de temps après avoir envahi le périplasme, la cellule hôte meurt et gonfle dans une structure sphérique appelée bdelloplaste, à l’intérieur de laquelle la cellule prédatrice s’allonge et reproduit ses chromosomes. Le processus de réplication commence à l’origine de réplication (oriC)6 et procède jusqu’à ce que plusieurs copies du chromosome ont été entièrement synthétisés7. Fait intéressant, la réplication de chaque chromosome n’est pas suivie d’une division cellulaire. Au lieu de cela, le prédateur s’allonge pour former une cellule longue, multinucléoïde et filamenteuse. Lors de l’épuisement des nutriments, le filament subit une septation synchrone et les cellules de descendance sont libérées du bdelloplaste8.
Avant que B. bacteriovorus puisse être utilisé comme antibiotique vivant contre les infections bactériennes, il est crucial de comprendre les principales étapes de son cycle de vie, en particulier celles liées à sa prolifération à l’intérieur de la proie. L’imagerie à cellules vivantes de B. bactériovorus a été difficile, en raison des diverses formes morphologiques du prédateur et de ses proies au cours du cycle de vie complexe. Jusqu’à présent, les interactions entre B. bactériovorus et sa cellule hôte ont été principalement étudiées par microscopie électronique et analyse snap-shot2,9,10, qui ont tous deux des limitations, surtout quand ils sont utilisés pour surveiller les étapes successives du cycle de vie prédateur.9 Ces méthodes fournissent des images à haute résolution des cellules B. bactériovorus et permettent l’observation d’un petit prédateur pendant la phase d’attaque ou de croissance. Cependant, ils ne permettent pas le suivi des cellules B. bactériovorus uniques tout au long des deux phases du cycle de vie.
Présenté ici est un protocole complet pour l’utilisation de la microscopie de fluorescence time-lapse (TLFM) pour surveiller le cycle de vie complet de B. bacteriovorus. Un système composé d’un tampon d’agarose est utilisé en combinaison avec un plat d’imagerie cellulaire, dans lequel les cellules prédatrices peuvent se déplacer librement sous le tampon agarose tandis que les cellules de proies immobilisées sont capables de former des bdelloplastes (Figure 2). Cette configuration est préparée à partir de souches spécifiques de E. coli et de B. bacteriovorus, mais le protocole peut être facilement modifié pour s’adapter aux souches individuelles d’un utilisateur (p. ex., portant différents marqueurs de sélection, protéines fusionnées avec différents fluorophores, etc.).
Dans ce cas, pour visualiser B. bactériovorus pendant la phase d’attaque, une souche spécifique (HD100 DnaN-mNeonGreen/PilZ-mCherry) a été construite qui exprime une version fluorescente de la protéine cytoplasmique, PilZ (disponible dans notre laboratoire sur demande)7. Cette souche produit en outre DnaN (la pince β-coulissante), une sous-unité d’ADN polymérase III holoenzyme, fusionnée avec une protéine fluorescente. Cela permet de surveiller la réplication continue de l’ADN à l’intérieur des cellules prédatrices au fur et à mesure qu’elles se développent dans les bdelloplastes.
Bien que le protocole et le logiciel décrits utilisés pour l’acquisition d’images se réfèrent à un microscope inversé fourni par un fabricant spécifique (voir tableau des matériaux),cette technique peut être ajustée pour tout microscope inversé équipé d’une chambre environnementale ou d’un autre support de chauffage externe et capable d’imagerie en time-lapse. Pour l’analyse des données, les utilisateurs peuvent choisir n’importe quel logiciel disponible compatible avec les formats de sortie individuels.
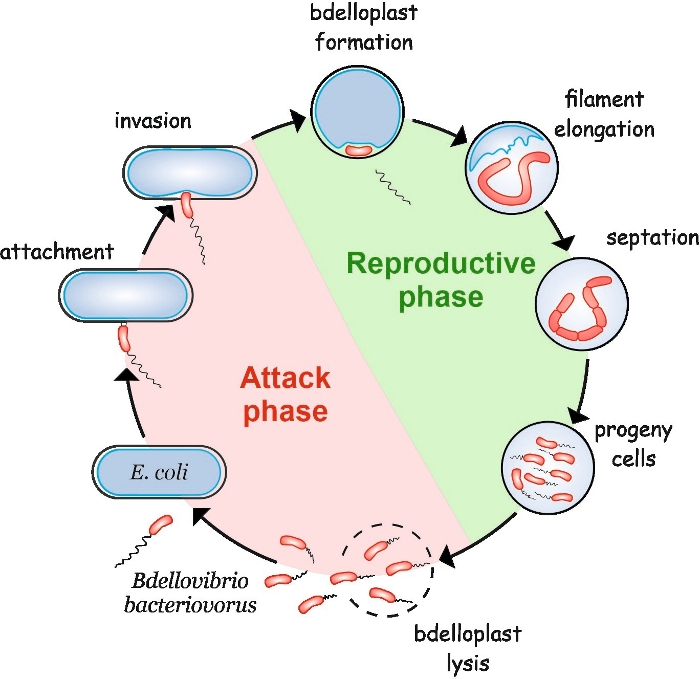
Figure 1 : Cycle de vie B. bactériovorus chez E. coli en tant que cellule hôte. Pendant la phase d’attaque, une cellule B. bactériovorus nage libre recherche et s’attache à une cellule hôte de E. coli. Après l’invasion, la cellule prédatrice devient localisée dans le périplasme de la proie, changeant la forme de la cellule hôte et formant un bdelloplaste. La phase de reproduction commence par la formation de bdelloplaste. La cellule prédatrice digère la cellule proie et réutilise des composés simples pour construire ses propres structures. B. bactériovorus se développe comme un long filament unique à l’intérieur du périplasme de l’hôte. Lorsque les ressources de la cellule proie sont épuisées, le filament de B. bactériovorus se produit de façon synchrone et forme des cellules de descendance. Après que les cellules de descendance développent leur flagelle, elles lysent le bdelloplast. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Protocol
Representative Results
Discussion
En raison de l’intérêt accru pour l’utilisation de B. bactériovorus comme antibiotique vivant, de nouveaux outils pour observer le cycle de vie prédateur, en particulier les interactions prédateur-pathogène, sont nécessaires. Le protocole présenté est utilisé pour suivre l’ensemble du cycle de vie de B. bacteriovorus, en particulier lors de sa croissance à l’intérieur de l’hôte, en temps réel. En outre, l’application d’une souche produisant une pince bêta fluorescente de l?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Cette étude a été soutenue par la subvention opus 2018/29/B/NZ6/00539 du Centre national des sciences à J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Referências
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

