टाइम-लैप्स फ्लोरेसेंस माइक्रोस्कोपी का उपयोग करके बैक्टीरियल शिकारी बीडीलोविब्रियो बैक्टीरियोवोस के जीवन चक्र की लाइव-सेल इमेजिंग
Summary
यहां प्रस्तुत एक प्रोटोकॉल है जो एक एगर उठे पैड और सेल-इमेजिंग व्यंजनों के संयोजन में समय-चूक फ्लोरेसेंस माइक्रोस्कोपी का उपयोग करके शिकारी जीवाणु Bdellovibrio बैक्टीरियोवोरस के पूर्ण जीवन चक्र की निगरानी का वर्णन करता है।
Abstract
Bdellovibrio जीवाणु एक छोटा ग्राम नकारात्मक, अनिवार्य शिकारी जीवाणु है कि हानिकारक रोगजनकों सहित अन्य ग्राम नकारात्मक बैक्टीरिया को मारता है। इसलिए इसे लिविंग एंटीबायोटिक माना जाता है। बी बैक्टीरियोवरस को जीवित एंटीबायोटिक के रूप में लागू करने के लिए, सबसे पहले इसके जटिल जीवन चक्र के प्रमुख चरणों को समझना आवश्यक है, विशेष रूप से शिकार के अंदर इसका प्रसार। अब तक, वास्तविक समय में शिकारी जीवन चक्र के लगातार चरणों की निगरानी करना चुनौतीपूर्ण रहा है । यहां प्रस्तुत बी बैक्टीरियोवरसके पूर्ण जीवन चक्र के वास्तविक समय इमेजिंग के लिए एक व्यापक प्रोटोकॉल है, विशेष रूप से मेजबान के अंदर इसके विकास के दौरान। इस उद्देश्य के लिए, एक एगरेग्मेंट पैड से मिलकर एक प्रणाली का उपयोग सेल-इमेजिंग व्यंजनों के संयोजन में किया जाता है, जिसमें शिकारी कोशिकाएं एगर उठे पैड के नीचे स्वतंत्र रूप से स्थानांतरित हो सकती हैं जबकि स्थिर शिकार कोशिकाएं bdelloplasts बनाने में सक्षम हैं। डीएनए पॉलीमरेज III के फ्लोरोसेंटी टैग किए गए एक तनाव का अनुप्रयोग बी बैक्टीरियोवोरस जीवन चक्र के प्रजनन चरण के दौरान गुणसूत्र प्रतिकृति की निगरानी करने की अनुमति देता है।
Introduction
Bdellovibrio जीवाणु एक छोटा है (0.3-0.5 माइक्रोन द्वारा 0.5-1.4 माइक्रोन) ग्राम-नकारात्मक जीवाणु जो अन्य ग्राम-नकारात्मक बैक्टीरिया पर शिकार करता है, जिसमें हानिकारक रोगजनकों जैसे क्लेबसिला निमोनिया, स्यूडोमोनास एरुगिनोसा और शिगेला फ्लेक्सनेरी1,2,,3शामिल हैं।, चूंकि बी बैक्टीरियोवरस रोगजनकों को मारता है, इसलिए इसे एक संभावित जीवित एंटीबायोटिक माना जाता है जिसे बैक्टीरियल संक्रमणों का मुकाबला करने के लिए लागू किया जा सकता है, विशेष रूप से मल्टीड्रग प्रतिरोधी उपभेदों के कारण।
B. बैक्टीरियोवरस दो चरणों से मिलकर एक अजीब जीवन चक्र प्रदर्शित करता है: एक मुक्त रहने वाले गैर-प्रतिकृति हमले का चरण और एक इंट्रासेलुलर प्रजनन चरण(चित्रा 1)। मुक्त रहने वाले चरण में, यह अत्यधिक मोती जीवाणु, जो 160 माइक्रोन/एस तक की गति से चलता है, अपने शिकार की खोज करता है। शिकार की बाहरी झिल्ली से जुड़ने के बाद, यह पेरिप्लाज्म4,,5में प्रवेश करता है। इंटरपरिपिप्लाज्मिक प्रजनन चरण के दौरान, बी बैक्टीरियोवोरस मेजबान के मैक्रोमॉलिक्यूल्स को नीचा दिखाने और अपने स्वयं के विकास के लिए उनका पुन: उपयोग करने के लिए हाइड्रोलिटिक एंजाइमों की अधिकता का उपयोग करता है। पेरिप्लाज्म पर हमला करने के तुरंत बाद, मेजबान कोशिका मर जाती है और एक गोलाकार संरचना में फूल जाती है जिसे एक ब्लाडेलोप्लास्ट कहा जाता है, जिसके अंदर शिकारी कोशिका अपने गुणसूत्रों को बढ़ाती है और प्रतिकृति बनाती है। प्रतिकृति प्रक्रिया प्रतिकृति मूल(ORIC)6 से शुरू होती है और तब तक आय होती है जब तक गुणसूत्र की कई प्रतियां पूरीतरहसे संश्लेषित नहीं हो जातीं . दिलचस्प बात यह है कि प्रत्येक गुणसूत्र की प्रतिकृति कोशिका विभाजन के बाद नहीं होती है। इसके बजाय, शिकारी एक लंबी, बहुनीय और फिलामेंटस सेल बनाने के लिए आगे बढ़ जाता है। पोषक तत्वों की कमी पर, फिलामेंट सिंक्रोनस सेप्टेशन से गुजरता है और संतान कोशिकाओं को 5डेलोप्लास्ट 8 से जारी कियाजाताहै।
इससे पहले कि बी बैक्टीरियोवरस बैक्टीरिया संक्रमण के खिलाफ एक जीवित एंटीबायोटिक के रूप में इस्तेमाल किया जा सकता है, यह अपने जीवन चक्र के प्रमुख चरणों को समझने के लिए महत्वपूर्ण है, विशेष रूप से शिकार के अंदर इसके प्रसार से संबंधित उन । जटिल जीवन चक्र के दौरान शिकारी और उसके शिकार के विभिन्न रूपात्मक रूपों के कारण बी बैक्टीरियोवरस की लाइव-सेल इमेजिंग चुनौतीपूर्ण रही है। अब तक, बी बैक्टीरियोवोरस और इसके मेजबान सेल के बीच बातचीत मुख्य रूप से इलेक्ट्रॉन माइक्रोस्कोपी और स्नैप-शॉट,विश्लेषण2,,9,10द्वारा अध्ययन की गई है, जिनमें से दोनों की सीमाएं हैं, खासकर जब उनका उपयोग शिकारी जीवन चक्र के क्रमिक चरणों की निगरानी के लिए किया जाता है। ये विधियां बी बैक्टीरियोवरस कोशिकाओं की उच्च-रिज़ॉल्यूशन छवियां प्रदान करती हैं और हमले या विकास चरण के दौरान एक छोटे शिकारी के अवलोकन को सक्षम करती हैं। हालांकि, वे दोनों जीवन चक्र चरणों में एकल बी बैक्टीरियोवरस कोशिकाओं की ट्रैकिंग की अनुमति नहीं देते हैं।
यहां प्रस्तुत बी बैक्टीरियोवोरसके पूर्ण जीवन चक्र की निगरानी के लिए समय-चूक फ्लोरेसेंस माइक्रोस्कोपी (टीएमएफएम) का उपयोग करने के लिए एक व्यापक प्रोटोकॉल है। एक प्रणाली जिसमें एक एग्राजिंग पैड होता है, जिसका उपयोग सेल-इमेजिंग डिश के संयोजन में किया जाता है, जिसमें शिकारी कोशिकाएं एगर उठे पैड के नीचे स्वतंत्र रूप से स्थानांतरित हो सकती हैं जबकि स्थिर शिकार कोशिकाएं bdelloplasts(चित्रा 2)बनाने में सक्षम हैं। यह सेट-अप ई कोलाई और बी बैक्टीरियोवरसदोनों के विशिष्ट उपभेदों के आधार पर तैयार किया जाता है, लेकिन प्रोटोकॉल को उपयोगकर्ता के व्यक्तिगत उपभेदों (उदाहरण के लिए, विभिन्न चयन मार्कर, विभिन्न फ्लोरोफोरस आदि के साथ जुड़े प्रोटीन) को फिट करने के लिए आसानी से बदला जा सकता है।
इस मामले में, हमले के चरण के दौरान बी बैक्टीरियोवरस की कल्पना करने के लिए, एक विशिष्ट तनाव (HD100 DnaN-mNeonGreen/PilZ-mCherry) का निर्माण किया गया था जो साइटोप्लाज्मिक प्रोटीन, पिल्ज़ (अनुरोध पर हमारी प्रयोगशाला में उपलब्ध)7के फ्लोरोसेंटली टैग किए गए संस्करण को व्यक्त करता है। यह तनाव अतिरिक्त रूप से डीएनएन (ए-स्लाइडिंग क्लैंप), डीएनए पॉलीमरेज III होलोएंजाइम का एक उपइकान, फ्लोरोसेंट प्रोटीन के साथ जुड़ा हुआ है। यह चल रहे डीएनए प्रतिकृति को शिकारी कोशिकाओं के अंदर निगरानी करने में सक्षम बनाता है क्योंकि वे bdelloplasts के भीतर बढ़ते हैं ।
यद्यपि छवि अधिग्रहण के लिए उपयोग किए जाने वाले वर्णित प्रोटोकॉल और सॉफ्टवेयर एक विशिष्ट निर्माता (सामग्री की तालिकादेखें) द्वारा प्रदान किए गए उल्टे माइक्रोस्कोप को संदर्भित करते हैं, इस तकनीक को पर्यावरण कक्ष या अन्य बाहरी हीटिंग धारक से लैस किसी भी उल्टे माइक्रोस्कोप के लिए समायोजित किया जा सकता है और समय-चूक इमेजिंग में सक्षम हो सकता है। डेटा विश्लेषण के लिए, उपयोगकर्ता व्यक्तिगत आउटपुट प्रारूपों के साथ संगत किसी भी उपलब्ध सॉफ्टवेयर का चयन कर सकते हैं।
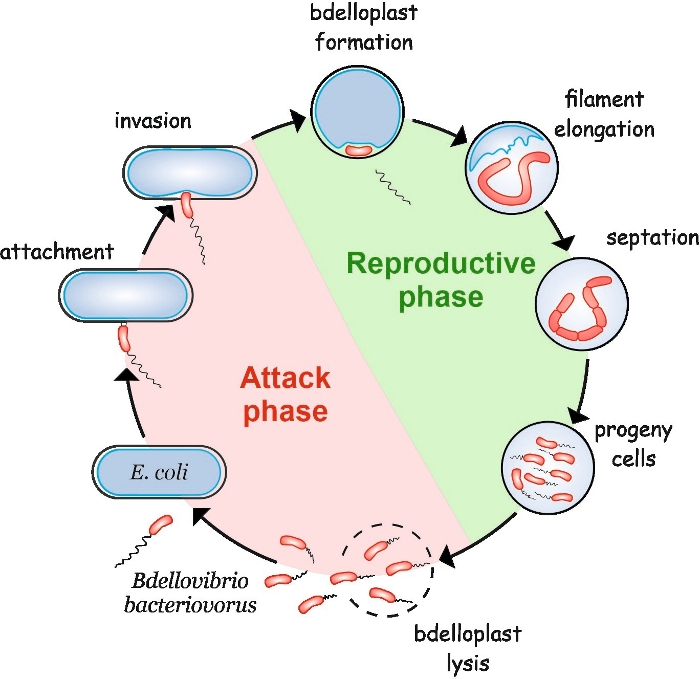
चित्रा 1: बी बैक्टीरियोवरस जीवन चक्र ई. कोलाई में एक मेजबान सेल के रूप में । हमले के चरण के दौरान, एक मुक्त तैराकी बी बैक्टीरियोवरस सेल के लिए खोज करता है और एक मेजबान ई. कोलाई सेल को देता है । आक्रमण के बाद, शिकारी कोशिका शिकार के पेरिप्लाज्म में स्थानीयकृत हो जाती है, मेजबान सेल के आकार को बदल देती है और एक 5डेलोप्लास्ट बनाती है। प्रजनन चरण bdelloplast गठन के साथ शुरू होता है। शिकारी कोशिका शिकार कोशिका को पचाती है और अपनी संरचनाओं का निर्माण करने के लिए सरल यौगिकों का पुन: उपयोग करती है। बी बैक्टीरियोवरस मेजबान के पेरिप्लाज्म के अंदर एक लंबे एकल फिलामेंट के रूप में बढ़ता है । जब शिकार सेल के संसाधन समाप्त हो जाते हैं, तो बी बैक्टीरियोवरस फिलामेंट समकालिक रूप से सेप्ट करता है और संतान कोशिकाओं का निर्माण करता है। संतान कोशिकाओं के बाद उनके फ्लैगेला विकसित होते हैं, वे ब्लाडेलोप्लास्ट को lyse करते हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
एक जीवित एंटीबायोटिक के रूप में बी बैक्टीरियोवरस का उपयोग करने में बढ़ी हुई रुचि के कारण, शिकारी जीवन चक्र, विशेष रूप से शिकारी-रोगजनक बातचीत को देखने के लिए नए उपकरणों की आवश्यकता है। प्रस्तुत प्र?…
Declarações
The authors have nothing to disclose.
Acknowledgements
इस अध्ययन को राष्ट्रीय विज्ञान केंद्र अनुदान रचना 2018/29/B/NZ6/00539 से J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Referências
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

