Zaman Atlamalı Floresan Mikroskopi kullanarak Bakteriyel Predator Bdellovibrio bakteriovorus Yaşam Döngüsünün Canlı Hücre Görüntüleme
Summary
Burada sunulan bir agarose ped ve hücre görüntüleme yemekleri ile birlikte zaman atlamalı floresan mikroskobu kullanarak yırtıcı bakteri Bdellovibrio bakteriovorus tam yaşam döngüsünün izlenmesi açıklayan bir protokoldür.
Abstract
Bdellovibrio bakteriovorus, zararlı patojenler de dahil olmak üzere diğer gram-negatif bakterileri öldüren küçük bir gram-negatif, zorunlu yırtıcı bakteridir. Bu nedenle, yaşayan bir antibiyotik olarak kabul edilir. Yaşayan bir antibiyotik olarak B. bakteriovorus uygulamak için, öncelikle karmaşık yaşam döngüsünün önemli aşamalarını anlamak için gereklidir, av içinde özellikle çoğalması. Şimdiye kadar, yırtıcı yaşam döngüsünün birbirini izleyen aşamalarını gerçek zamanlı olarak izlemek zor olmuştur. Burada sunulan B. bakteriovorustam yaşam döngüsünün gerçek zamanlı görüntüleme için kapsamlı bir protokol , özellikle ev sahibi içinde büyüme sırasında. Bu amaçla, bir agarose ped oluşan bir sistem hücre görüntüleme yemekleri ile birlikte kullanılır, hangi yırtıcı hücreler agarose ped altında serbestçe hareket edebilir ise hareketsiz av hücreleri bdelloplastlar oluşturmak edebiliyoruz. DNA polimeraz III’ün floresan etiketli β-subunit’ini üreten bir suş uygulaması, B. bakteriovorus yaşam döngüsünün üreme aşamasında kromozom replikasyonunun izlenmesini sağlar.
Introduction
Bdellovibrio bakteriovorus klebsiella pneumoniae, Pseudomonas aeruginosa ve Shigella flexneri1,,2,3gibi zararlı patojenler de dahil olmak üzere diğer gram-negatif bakteriler, avlar gram-negatif bakteri küçük (0.3-0.5 μm 0.5-1.4 μm) gram-negatif bakteri olduğunu . B. bakteriovorus patojenleri öldürdüğünden, bakteriyel enfeksiyonlarla mücadele de uygulanabilecek potansiyel bir canlı antibiyotik olarak kabul edilir, özellikle de çoklu ilaca dirençli suşların neden olduğu antibiyotikler.
B. bakteriovorus iki aşamadan oluşan kendine özgü bir yaşam döngüsü sergiler: serbest yaşayan non-replicative saldırı fazı ve hücre içi üreme evresi(Şekil 1). Serbest yaşam evresinde, 160 m/s’ye varan hızlarda hareket eden bu son derece hareketli bakteri avını arar. Avın dış zarına bağlandıktan sonra periplazmaya4,5girer. İnperiplazmik üreme evresi sırasında, B. bacteriovorus konağın makromoleküllerini alçaltmak ve kendi büyümesi için yeniden kullanmak için hidrolitik enzimlerin bir bolluk kullanır. Periplazmayı istila ettikten kısa bir süre sonra, konak hücre ölür ve bdelloplast adı verilen küresel bir yapıya dönüşür ve içinde yırtıcı hücre kromozomlarını uzatır ve çoğaltır. Çoğaltma işlemi çoğaltma kökenli başlar (oriC)6 ve kromozom un birkaç kopya tamamen sentezlenene kadar devameder 7. İlginçtir, her kromozomun replikasyonu hücre bölünmesi tarafından takip edilmez. Bunun yerine, yırtıcı uzun, multinükleoid ve ipliksi bir hücre oluşturmak için uzatır. Besin tükenmesi üzerine, filament senkron septasyon uğrar ve döl hücreleri bdelloplast serbest bırakılır8.
B. bakteriovorus bakteriyel enfeksiyonlara karşı yaşayan bir antibiyotik olarak kullanılabilir önce, onun yaşam döngüsünün önemli aşamalarını anlamak için çok önemlidir, özellikle av içinde çoğalması ile ilgili olanlar. B. bakteriovorus’un canlı hücre görüntülemesi, karmaşık yaşam döngüsü sırasında yırtıcının ve avının çeşitli morfolojik formları nedeniyle zor olmuştur. Şimdiye kadar, B. bakteriovorus ve konak hücre arasındaki etkileşimler ağırlıklı olarak elektron mikroskobu ve snap-shot analizi 2 tarafından incelenmiştir,,9,10, her ikisi de sınırlamalar var, özellikle de yırtıcı yaşam döngüsünün ardışık aşamalarını izlemek için kullanılır. Bu yöntemler B. bakteriovorus hücrelerinin yüksek çözünürlüklü görüntülerini sağlar ve saldırı veya büyüme aşamasında küçük bir yırtıcının gözlemini sağlar. Ancak, her iki yaşam döngüsü aşamalarında tek B. bakteriovorus hücrelerinin izlenmesine izin vermezler.
Burada sunulan b. bakteriovorustam yaşam döngüsünü izlemek için zaman atlamalı floresan mikroskop (TLFM) kullanmak için kapsamlı bir protokoldür. Agarose pedden oluşan bir sistem, hücre görüntüleme çanaklarıyla birlikte kullanılır, bu da yırtıcı hücrelerin agarose pedin altında serbestçe hareket edebilmesi ve hareketsiz av hücrelerinin bdelloplastlar oluşturabildiği bir yerdir(Şekil 2). Bu kurulum hem E. coli hem de B. bacteriovorus’unspesifik suşlarına göre hazırlanır, ancak protokol kullanıcının bireysel suşlarına uyacak şekilde kolayca değiştirilebilir (örn. farklı seçim işaretleri taşıyan proteinler, farklı floroforlarla kaynaşmış proteinler, vb.).
Bu durumda, saldırı aşamasında B. bakteriovorus görselleştirmek için, belirli bir gerginlik (HD100 DnaN-mNeonGreen/PilZ-mCherry) sitoplazmaik protein, PilZ (istek üzerine laboratuvarda mevcut) bir floresan etiketli sürümünü ifade inşa edilmiştir7. Bu suşu ayrıca DNA polimeraz III holoenziminin bir alt birimi olan ve floresan proteinle kaynaşmış DnaN (β-sürgülü kıskaç) üretir. Bu, bdelloplastlar içinde büyüdükçe yırtıcı hücrelerin içinde devam eden DNA replikasyonunun izlenmesini sağlar.
Görüntü edinimi için kullanılan açıklanan protokol ve yazılım, belirli bir üretici tarafından sağlanan ters bir mikroskopa atıfta bulunsa da (bkz. Malzemeler Tablosu),bu teknik, çevre odası veya diğer harici ısıtma tutucusu yla donatılmış ve hızlandırılmış görüntüleme yeteneğine sahip ters mikroskop için ayarlanabilir. Veri analizi için, kullanıcılar tek tek çıktı biçimleriyle uyumlu herhangi bir kullanılabilir yazılım seçebilir.
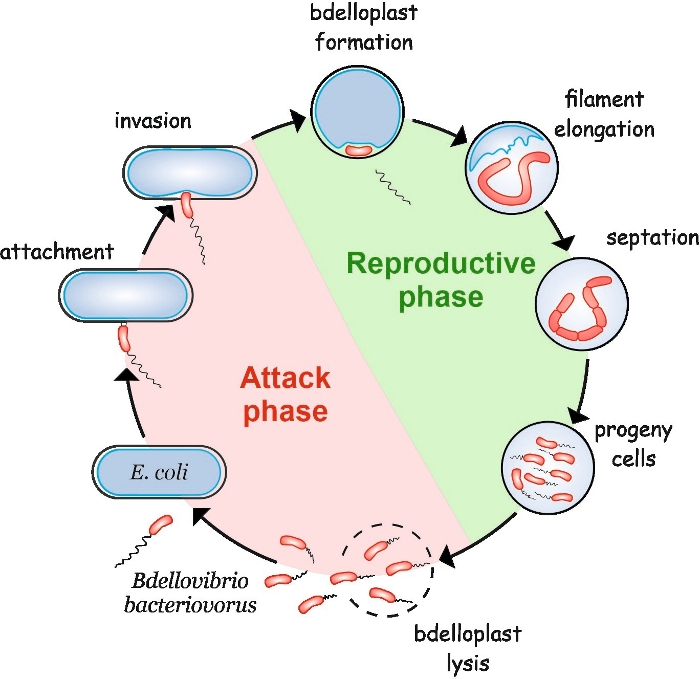
Şekil 1: E. coli’de ana hücre olarak B. bakteriovorus yaşam döngüsü. Saldırı evresinde, serbest yüzen bir B. bakteriovorus hücresi konakçı E. coli hücreyi arar ve ona bağlanır. İstiladan sonra yırtıcı hücre avın periplazmasında lokalize olur, konak hücrenin şeklini değiştirir ve bir bdelloplast oluşturur. Üreme evresi bdelloplast oluşumu ile başlar. Yırtıcı hücre av hücresini sindirir ve kendi yapılarını oluşturmak için basit bileşikleri yeniden kullanır. B. bakteriovorus konak periplazmı içinde uzun bir tek filament olarak büyür. Av hücresinin kaynakları tükendiğinde, B. bakteriovorus filamenti senkronize olarak septates ve singeny hücreleri oluşturur. Döl hücreleri kamçılarını geliştirdikten sonra bdelloplastı lyse olarak verirler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Yaşayan bir antibiyotik olarak B. bakteriovorus kullanarak artan ilgi nedeniyle, yırtıcı yaşam döngüsü gözlemlemek için yeni araçlar, özellikle yırtıcı-patojen etkileşimleri, ihtiyaç vardır. Sunulan protokol, özellikle ev sahibi nin içinde büyümesi sırasında, tüm B. bakteriovorus yaşam döngüsünü gerçek zamanlı olarak izlemek için kullanılır. Ayrıca, DNA polimeraz III holoenzimfloresan etiketli beta kıskacı üreten bir suş uygulaması B. bakteriovorusüreme…
Declarações
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Ulusal Bilim Merkezi hibe Opus tarafından desteklenmiştir 2018/29/B/NZ6/00539 J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
Referências
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

