عزل السوائل القريبة للتحقيق في البيئة الدقيقة للورم من سرطان البنكرياس الغدي
Summary
عصير البنكرياس هو مصدر ثمين للمؤشرات الحيوية لسرطان البنكرياس البشري. نصف هنا طريقة لإجراء الجمع أثناء الجراحة. للتغلب على التحدي المتمثل في اعتماد هذا الإجراء في نماذج الفئران ، نقترح عينة بديلة ، السائل الخلالي للورم ، ونصف هنا بروتوكولين لعزله.
Abstract
سرطان البنكرياس الغدي (PDAC) هو السبب الرئيسي الرابع للوفاة المرتبطة بالسرطان ، وسرعان ما يصبح السبب الثاني. هناك حاجة ملحة للمتغيرات المرتبطة بأمراض البنكرياس المحددة للمساعدة في التشخيص التفريقي قبل الجراحة وتوصيف المريض. عصير البنكرياس هو سائل جسم غير مستكشف نسبيا ، والذي ، بسبب قربه من موقع الورم ، يعكس التغيرات في الأنسجة المحيطة. هنا نصف بالتفصيل إجراء الجمع أثناء الجراحة. لسوء الحظ ، فإن ترجمة مجموعة عصير البنكرياس إلى نماذج الفئران من PDAC ، لإجراء دراسات ميكانيكية ، أمر صعب للغاية من الناحية الفنية. السائل الخلالي الورمي (TIF) هو السائل خارج الخلية ، خارج الدم والبلازما ، والذي يستحم الخلايا السرطانية واللحمية. على غرار عصير البنكرياس ، بالنسبة لخصائصه لجمع وتركيز الجزيئات الموجودة في البلازما ، يمكن استغلال TIF كمؤشر على التغيرات البيئية الدقيقة وكمصدر قيم للمؤشرات الحيوية المرتبطة بالأمراض. نظرا لأن TIF لا يمكن الوصول إليه بسهولة ، فقد تم اقتراح تقنيات مختلفة لعزله. نصف هنا طريقتين بسيطتين ومتساهلتين تقنيا لعزله: الطرد المركزي للأنسجة وإزالة الأنسجة.
Introduction
سرطان البنكرياس الغدي القنوي (PDAC) هو واحد من الأورام الأكثر عدوانية ، وسرعان ما يصبح السبب الرئيسي الثاني للوفاة1،2،3. وهي معروفة ببيئتها الدقيقة المثبطة للمناعة وعدم استجابتها لبروتوكولات العلاج المناعي4. حاليا ، لا يزال الاستئصال الجراحي هو الخيار العلاجي الوحيد ل PDAC ، ولكن هناك تواتر عال من الانتكاسات المبكرة ومضاعفات ما بعد الجراحة. عدم وجود أعراض محددة حتى مرحلة متقدمة لا يسمح بالتشخيص المبكر ، مما يساهم في المواعيد النهائية للمرض. علاوة على ذلك ، فإن تداخل الأعراض بين PDAC وأمراض البنكرياس الحميدة الأخرى يمكن أن يعوق تحقيق تشخيص سريع وموثوق به مع استراتيجيات التشخيص الحالية. يمكن أن يؤدي تحديد المتغيرات المرتبطة بأمراض البنكرياس المحددة إلى تسهيل عملية صنع القرار الجراحي وتحسين تنميط المريض.
تم تحقيق نتائج واعدة في اكتشاف المؤشرات الحيوية باستخدام سوائل الجسم التي يسهل الوصول إليها ، مثل الدم5،6،7 ، البول8 ، اللعاب9 وعصير البنكرياس 10،11،12. وقد استغلت العديد من الدراسات نهج “omics” الشاملة ، مثل التقنيات الجينومية والبروتينية والأيضية ، لتحديد الجزيئات أو التوقيعات المرشحة التي يمكن أن تميز بين PDAC وغيرها من أمراض البنكرياس الحميدة. لقد أثبتنا مؤخرا أن عصير البنكرياس ، وهو سائل جسم غير مستكشف نسبيا ، يمكن استخدامه لتحديد التوقيعات الأيضية للمرضى الذين لديهم ملامح سريرية متميزة12. عصير البنكرياس هو سائل غني بالبروتين ، والذي يتراكم إفراز خلايا قنوات البنكرياس ويتدفق إلى قناة البنكرياس الرئيسية ، ثم إلى القناة الصفراوية المشتركة الرئيسية. نظرا لقربه من البنكرياس ، يمكن أن يتأثر بشدة بالاضطرابات البيئية الدقيقة التي تسببها كتلة الورم (الشكل 1) ، وبالتالي فهو أكثر إفادة من الدم أو البول ، أو التنميط القائم على الأنسجة. استكشفت العديد من الدراسات إمكانات عصير البنكرياس لتحديد المؤشرات الحيوية الجديدة للمرض باستخدام أساليب مختلفة ، بما في ذلك التحليل الخلوي 13 ، والتحليل البروتيني الذي أجراه قياس الطيف الكتلي 14,15 ، وتقييم العلامات الجينية واللاجينية مثل طفرات K-ras و p53 16,17 ، والتغيرات في مثيلة الحمض النووي 18 ، و miRNAs 19 . من الناحية الفنية ، يمكن جمع عصير البنكرياس أثناء الجراحة أو بإجراءات طفيفة التوغل ، مثل الموجات فوق الصوتية بالمنظار ، أو تصوير البنكرياس الصفراوي الرجعي ، أو عن طريق الجمع بالمنظار لإفراز عصير الاثني عشر20. ليس من الواضح بعد إلى أي مدى يتأثر تكوين عصير البنكرياس بتقنية الجمع المستخدمة. نصف هنا إجراء الجمع أثناء العملية الجراحية ونوضح أن عصير البنكرياس يمكن أن يمثل مصدرا ثمينا للمؤشرات الحيوية PDAC.
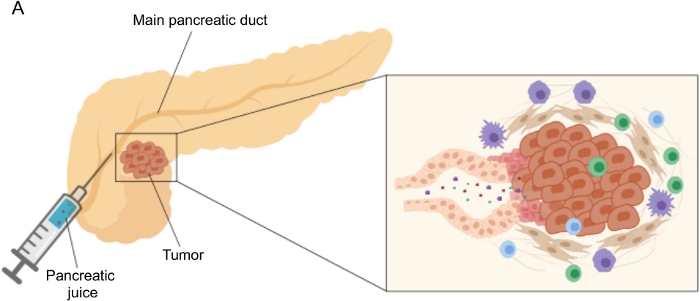
الشكل 1: التمثيل التخطيطي لجمع عصير البنكرياس. (أ) تمثيل تخطيطي يصور إفراز عصير البنكرياس في قناة البنكرياس وجمعه أثناء الجراحة. يظهر الجزء الداخلي صورة مقربة للبيئة الدقيقة للورم: يجمع عصير البنكرياس الجزيئات التي تطلقها الخلايا السرطانية واللحمية في قنوات البنكرياس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
سيكون جمع عصير البنكرياس في نماذج الفئران الوراثية وتقويم العظام من PDAC موضع تقدير من منظور استغلال هذا السائل الحيوي في الدراسات الميكانيكية قبل السريرية. ومع ذلك ، يمكن أن يكون هذا الإجراء صعبا للغاية من الناحية الفنية وغير ممكن للنماذج الأبسط مثل الأورام تحت الجلد. لهذا السبب ، حددنا السائل الخلالي للورم (TIF) كمصدر بديل لعصير البنكرياس ، لخصائصه المماثلة المتمثلة في العمل كمؤشر على الاضطرابات المحيطة. السائل الخلالي (IF) هو السائل خارج الخلية ، الموجود خارج الأوعية الدموية واللمفاوية ، والذي يستحم خلايا الأنسجة21. يتأثر تكوين IF بكل من الدورة الدموية للعضو والإفراز المحلي ؛ في الواقع ، تنتج الخلايا المحيطة بنشاط وتفرز البروتينات في IF21. يعكس الخلالي التغيرات البيئية الدقيقة للأنسجة المحيطة ، وبالتالي يمكن أن يمثل مصدرا قيما لاكتشاف المؤشرات الحيوية في العديد من السياقات المرضية ، مثل الأورام. يمكن استخدام التركيز العالي للبروتينات المفرزة محليا في TIF لتحديد الجزيئات المرشحة لاختبارها كمؤشرات حيوية تنبؤية أو تشخيصية في البلازما22،23،24. أثبتت العديد من الدراسات أن TIF عينة مناسبة للنهج البروتينية عالية الإنتاجية ، مثل تقنيات قياس الطيف الكتلي 23،24،25 ، وكذلك نهج ELISA متعدد الإرسال26 ، وتوصيف الحمض النووي الريبي الميكروي27.
تم اقتراح عدة طرق لعزل IF في الأورام ، والتي يمكن تصنيفها على نطاق واسع على أنها في الجسم الحي (الترشيح الفائق الشعري 28،29،30،31 وغسيل الكلى المجهري32،33،34،35) وطرق خارج الجسم الحي (الطرد المركزي للأنسجة22،36،37،38 و إزالة الأنسجة39،40،41،42). تمت مراجعة هذه التقنيات بتفصيل واسعالنطاق 43,44. وينبغي أن يأخذ اختيار الطريقة المناسبة في الحسبان مسائل من قبيل التحليلات والتطبيقات النهائية والحجم المسترد. استخدمنا مؤخرا هذا النهج كدليل على المبدأ لإثبات النشاط الأيضي المختلف للأورام من خطين من خلايا سرطان البنكرياس الغدي الفئران12. استنادا إلى الأدبيات24,38 ، اخترنا استخدام طريقة الطرد المركزي منخفضة السرعة لتجنب كسر الخلايا وتخفيفها من المحتوى داخل الخلايا. تعكس كل من كمية الجلوكوز واللاكتات في TIF الخصائص المختلفة للتحلل السكري لخطي الخلايا المختلفين. هنا نصف بالتفصيل بروتوكول الطريقتين الأكثر استخداما لعزل TIF: الطرد المركزي للأنسجة وإزالة الأنسجة (الشكل 2).
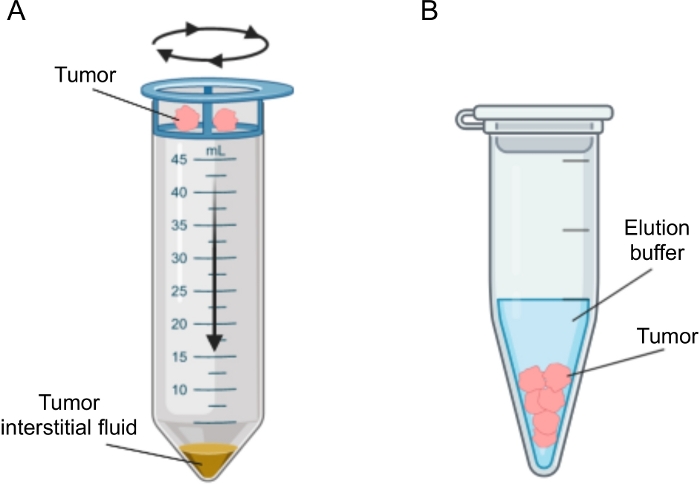
الشكل 2: التمثيل التخطيطي لطرق عزل السائل الخلالي للورم. توضيح تخطيطي للتقنيات الموصوفة بالتفصيل في البروتوكول ، وهي الطرد المركزي للأنسجة (A) وإزالة الأنسجة (B). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
في هذه الدراسة ، وصفنا تقنية جمع عصير البنكرياس أثناء العملية الجراحية ، وهي خزعة سائلة غير مستكشفة إلى حد كبير. لقد أظهرنا مؤخرا أنه يمكن استغلال عصير البنكرياس كمصدر للعلامات الأيضية للمرض12. أظهر تحليل الأيض على الخزعات السائلة الأخرى ، مثل الدم5،6…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونشكر روبرتا ميغليوري على المساعدة التقنية. تلقى البحث الذي أدى إلى هذه النتائج تمويلا من الجمعية الإيطالية للبحوث في كانكرو (AIRC) في إطار مشروع IG2016-ID.18443 – P.I. Marchesi Federica. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو اتخاذ قرار النشر أو إعداد المخطوطة.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
References
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Cancer Research. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

