췌장 선암의 종양 미세 환경을 조사하기위한 근위액 분리
Summary
췌장액은 인간 췌장암에 대한 바이오마커의 귀중한 공급원입니다. 여기서는 수술 중 수집 절차 방법을 설명합니다. 쥐 모델에서 이 절차를 채택하는 문제를 극복하기 위해 대체 샘플인 종양 간질액을 제안하고 여기에서 분리를 위한 두 가지 프로토콜을 설명합니다.
Abstract
췌장 선암종 (PDAC)은 암 관련 사망의 네 번째 주요 원인이며 곧 두 번째가 될 것입니다. 수술 전 감별 진단 및 환자 프로파일 링을 돕기 위해 특정 췌장 병리와 관련된 변수가 시급히 필요합니다. 췌장액은 상대적으로 탐험되지 않은 체액으로, 종양 부위와 가깝기 때문에 주변 조직의 변화를 반영합니다. 여기에서는 수술 중 수집 절차에 대해 자세히 설명합니다. 불행히도 췌장액 수집을 PDAC의 쥐 모델로 번역하여 기계 론적 연구를 수행하는 것은 기술적으로 매우 어렵습니다. 종양 간질 액 (TIF)은 종양 및 기질 세포를 목욕시키는 혈액 및 혈장 외부의 세포 외액입니다. 췌장액과 유사하게, 혈장에서 희석된 것으로 밝혀진 분자를 수집하고 농축하는 특성 때문에 TIF는 미세환경 변화의 지표 및 질병 관련 바이오마커의 귀중한 공급원으로 활용될 수 있습니다. TIF는 쉽게 접근할 수 없기 때문에, 그 분리를 위해 다양한 기술이 제안되었다. 여기서는 분리를 위한 간단하고 기술적으로 까다로운 두 가지 방법인 조직 원심분리와 조직 용출에 대해 설명합니다.
Introduction
췌장 관 선암 (PDAC)은 가장 공격적인 종양 중 하나이며 곧 두 번째 주요 사망 원인이 될 것입니다 1,2,3. 면역 억제 미세 환경과 면역 요법 프로토콜4에 대한 무반응으로 잘 알려져 있습니다. 현재 외과적 절제술은 여전히 PDAC의 유일한 치료 옵션이지만 조기 재발 및 수술 후 합병증의 빈도가 높습니다. 고급 단계까지 특정 증상이 없으면 조기 진단이 불가능하여 질병의 종말에 기여합니다. 또한, PDAC와 다른 양성 췌장 병리 사이의 증상의 중복은 현재의 진단 전략으로 신속하고 신뢰할 수있는 진단의 달성을 방해 할 수 있습니다. 특정 췌장 병리와 관련된 변수의 식별은 수술 의사 결정 과정을 용이하게하고 환자 프로파일 링을 개선 할 수 있습니다.
바이오마커 발견에서 유망한 결과는 혈액 5,6,7, 소변8, 타액 9 및 췌장액10,11,12와 같이 쉽게 접근할 수 있는 체액을 사용하여 달성되었습니다. 많은 연구에서 PDAC와 다른 양성 췌장 질환을 구별할 수 있는 후보 분자 또는 시그니처를 식별하기 위해 게놈, 단백질체학 및 대사체학 기술과 같은 포괄적인 “오믹스” 접근 방식을 활용했습니다. 우리는 최근에 상대적으로 탐험되지 않은 체액인 췌장액을 사용하여 뚜렷한 임상 프로필을 가진 환자의 대사 시그니처를 식별할 수 있음을 입증했습니다12. 췌장액은 단백질이 풍부한 액체로 췌장 덕트 세포의 분비물을 축적하여 주 췌장 덕트로 흐른 다음 주 담관으로 흐릅니다. 췌장과의 근접성으로 인해 종양 덩어리에 의해 유도 된 미세 환경 섭동 (그림 1)에 크게 영향을받을 수 있으므로 혈액이나 소변 또는 조직 기반 프로파일 링보다 더 유익합니다. 여러 연구에서 세포학적 분석13, 질량분석법14,15에 의해 수행된 단백질체학적 분석, K-ras 및 p53 돌연변이와 같은 유전적 및 후성유전학적 마커의 평가16,17, DNA 메틸화18 및 miRNA의 변화19를 포함한 다양한 접근 방식을 사용하여 질병의 새로운 바이오마커를 식별하는 췌장액의 잠재력을 탐구했습니다. . 기술적으로, 췌장액은 수술 중 또는 내시경 초음파, 역행 담관 – 췌장 조영술과 같은 최소 침습적 절차 또는 십이지장 주스 분비물20의 내시경 수집에 의해 수집 될 수있다. 췌장액 성분이 사용 된 수집 기술에 의해 어느 정도 영향을 받는지는 아직 명확하지 않습니다. 우리는 여기에서 수술 중 수집 절차를 설명하고 췌장액이 PDAC 바이오마커의 귀중한 공급원이 될 수 있음을 보여줍니다.
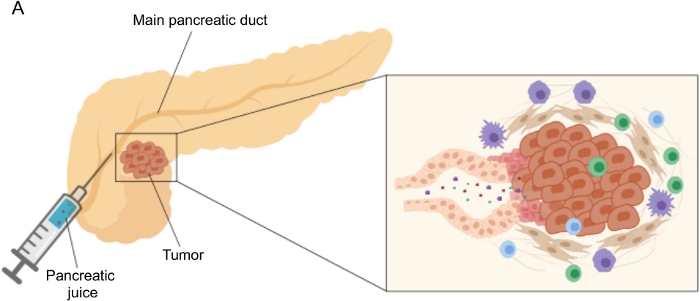
그림 1: 췌장액 수집의 개략적 표현. (A) 췌장액이 췌관으로 분비되고 수술 중 수집되는 것을 묘사하는 개략적 표현. 삽입물은 종양 미세 환경의 클로즈업을 보여줍니다 : 췌장액은 췌장 덕트의 종양 및 기질 세포에 의해 방출되는 분자를 수집합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
PDAC의 유전 및 동종 마우스 모델에서 췌장액 수집은 전임상 기계 론적 연구에서이 생체 유체를 활용하는 관점에서 높이 평가 될 것이다. 그러나이 절차는 기술적으로 매우 어려울 수 있으며 피하 종양과 같은 단순한 모델에는 적합하지 않습니다. 이러한 이유로 우리는 종양 간질 액 (TIF)을 췌장액의 대체 공급원으로 확인했는데, 이는 주변 섭동의 지표 역할을하는 유사한 특성 때문입니다. 간질 액 (IF)은 혈액 및 림프관 외부에서 발견되는 세포 외 액체이며, 조직 세포(21)를 목욕시킵니다. IF 조성물은 장기로의 혈액 순환과 국소 분비 모두에 의해 영향을받습니다. 사실, 주변 세포는 IF21에서 단백질을 적극적으로 생산하고 분비합니다. 간질은 주변 조직의 미세 환경 변화를 반영하므로 종양과 같은 여러 병리학 적 맥락에서 바이오 마커 발견을위한 귀중한 원천이 될 수 있습니다. TIF에서 국소 분비된 단백질의 고농도는 혈장22,23,24에서 예후 또는 진단적 바이오마커로서 시험될 후보 분자를 확인하는데 사용될 수 있다. 여러 연구에서 TIF가 질량 분석 기술23,24,25, 다중 ELISA 접근법26 및 microRNA 프로파일링 27과 같은 고처리량 단백질체학 접근법에 적합한 샘플임이 입증되었습니다.
종양에서 IF의 분리를 위해 몇 가지 접근법이 제안되었으며, 이는 생체 내 (모세관 한외 여과 28,29,30,31 및 미세 투석 32,33,34,35) 및 생체 외 방법 (조직 원심 분리22,36,37,38 및 조직 용출 39,40,41,42). 이러한 기술은43,44에서 광범위하게 검토되었습니다. 적절한 방법을 선택할 때는 다운스트림 분석 및 애플리케이션과 복구된 볼륨과 같은 문제를 고려해야 합니다. 우리는 최근에 두 개의 쥐 췌장 선암 세포주12에서 종양의 다른 대사 활성을 입증하기 위한 원리 증명으로 이 접근법을 사용했습니다. 문헌24,38에 기초하여, 우리는 세포 내 내용물로 인한 세포 파손 및 희석을 피하기 위해 저속 원심 분리 방법을 사용하기로 결정했습니다. TIF에서 포도당과 락테이트의 양은 모두 두 개의 상이한 세포주의 상이한 해당 특성을 반영하였다. 여기에서는 TIF 분리에 가장 일반적으로 사용되는 두 가지 방법인 조직 원심분리와 조직 용리에 대한 프로토콜을 자세히 설명합니다(그림 2).
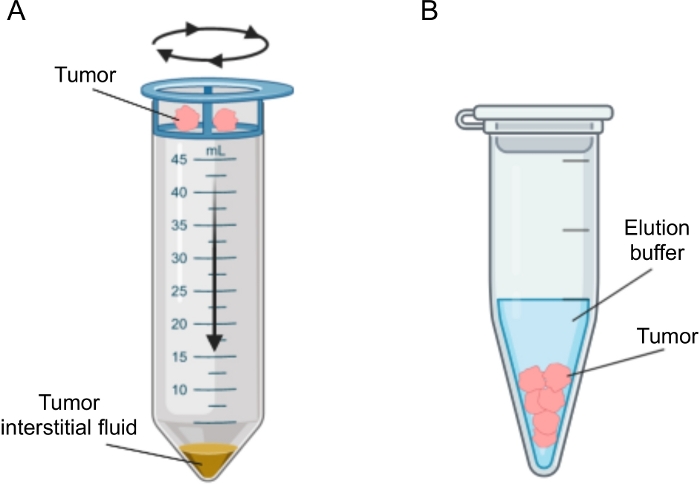
그림 2: 종양 간질액 분리 방법의 개략적 표현. 프로토콜에 상세히 기술된 기술, 즉 조직 원심분리(A) 및 조직 용출(B)의 개략도를 도시한 것이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 연구에서 우리는 대부분 탐험되지 않은 유체 생검 인 췌장액을 수술 중 수집하는 기술을 설명했습니다. 우리는 최근에 췌장액이 질병12의 대사 마커의 원천으로 이용 될 수 있음을 보여주었습니다. 혈액 5,6,7, 소변8 및 타액9와 같은 다른 액체 생검에 대한 대사체 분석은 …
Declarações
The authors have nothing to disclose.
Acknowledgements
기술 지원에 대해 Roberta Migliore에게 감사드립니다. 이러한 결과로 이어지는 연구는 IG2016-ID.18443 프로젝트 – P.I. Marchesi Federica에 따라 Associazione Italiana per la ricerca sul cancro (AIRC)로부터 자금을 지원 받았습니다. 자금 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할도 하지 않았습니다.
Materials
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Referências
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O’Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Pesquisa do Câncer. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors – a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).

