In vitro Time-lapse Live-Cell Imaging for å utforske cellemigrasjon mot Corti-organet
Summary
I denne studien presenterer vi en sanntidsavbildningsmetode ved hjelp av konfokal mikroskopi for å observere celler som beveger seg mot skadet vev ved eksvivosinkubasjon med cochlea-epitelet som inneholder Cortis organ.
Abstract
For å studere effekten av mesenchymale stamceller (MSC) på celleregenerering og behandling, sporer denne metoden MSC-migrasjon og morfologiske endringer etter samkultur med cochlea epitel. Cortis organ ble immobilisert på en plastdekslerlip ved å trykke på en del av Reissners membran generert under disseksjonen. MSCer begrenset av en glasssylinder migrerte mot cochlea epitel da sylinderen ble fjernet. Deres dominerende lokalisering ble observert i modiolus av Corti-organet, justert i en retning som ligner på nervefibrene. Noen MSCer ble imidlertid lokalisert i limbussområdet og viste en horisontalt langstrakt form. I tillegg ble migrasjon til hårcelleområdet økt, og morfologien til MSCene endret seg til ulike former etter kanamycinbehandling. Til slutt indikerer resultatene av denne studien at kokulturen av MSC med cochlea epitel vil være nyttig for utvikling av terapeutiske behandlinger via celletransplantasjon og for studier av celleregenerering som kan undersøke ulike forhold og faktorer.
Introduction
Hørselstap kan forekomme medfødt eller kan forårsakes gradvis av flere faktorer, inkludert aldring, narkotika og støy. Hørselstap er ofte vanskelig å behandle fordi det er svært utfordrende å gjenopprette nedsatt funksjon når hårcellene som er ansvarlige for hørselen er skadet1. Ifølge Verdens helseorganisasjon anslås 461 millioner mennesker over hele verden å ha hørselstap, noe som utgjør 6,1% av verdens befolkning. Av dem med hørselstap er 93 % voksne, og 7 % er barn.
En rekke tilnærminger har blitt forsøkt behandlet med hørselstap; spesielt har en regenereringstilnærming ved hjelp av MSC dukket opp som en lovende behandling. Når vev er skadet, slippes MSC naturlig ut i sirkulasjonssystemet og migrerer til skadestedet der de skiller ut ulike molekyler for å danne et mikromiljø som fremmer regenerering2. Derfor er det viktig å utvikle en metode for å behandle skadede vev gjennom migrering av eksternt implanterte MSCer for å målrette organer og deres etterfølgende sekresjon av molekyler som forårsaker potent immunregulering, angiogenese og anti-apoptose for å forbedre restaureringen av skadet cellefunksjon3,4,5.
Homing prosessen der MSCs migrerer til skadet vev kan være det viktigste hinderet å overvinne. MSCer har en systemisk homing-mekanisme med sekvensielle trinn for tethering/valsing, aktivering, arrestasjon, transmigrasjon/diapedese og migrering6,7,8. For tiden arbeides det med å identifisere måter å forbedre disse trinnene på. Ulike strategier, inkludert genetisk modifikasjon, celleoverflateteknikk, in vitro-grunning og magnetisk veiledning, er testet6,7. I tillegg er det gjort flere forsøk på å fremme beskyttelse og regenerering av auditive hårceller ved å homing MSCs til stedet for skadet cochlea. Sporing av MSCer in vivo er imidlertid tidkrevende og arbeidskrevende og krever svært spesialiserte ferdigheter9.
For å løse dette problemet ble det utviklet en metode for å observere homing av MSCer i cochlea gjennom tidsforløp konfokal mikroskopi som fotograferer migrering av celler over flere timer (Figur 1). Den ble utviklet tidlig på 1900-tallet og har nylig blitt et kraftig verktøy for å studere migrasjon av spesifikke celler.
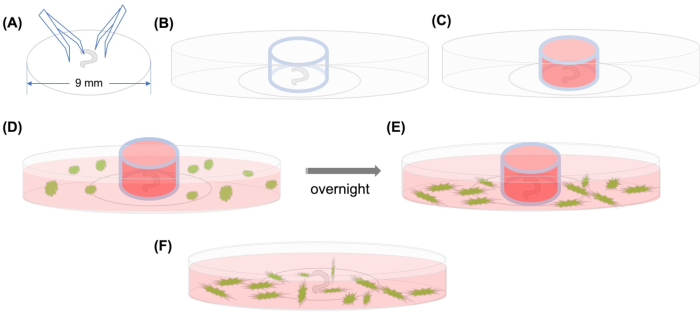
Figur 1: Grafisk abstrakt. (A) Etter at det dissekerte organet til Corti er festet på en plastdekslelip ved hjelp av tang, plasseres dekslene på en 35 mm glassbunnet konfokal mikroskopisk tallerken, og (B) glasssylinderen er plassert. (C) Etter at du har fylt innsiden av glasssylinderen med middels, legges GFP-merkede MSCer med medium forsiktig utenfor sylinderen (D) GFP-merkede MSCer med medium. (E) Etter inkubasjon over natten, (F) fjernes glasssylinderen, og bilder tas med et konfokalt mikroskop. Forkortelser: GFP = grønt fluorescerende protein; MSC = mesenchymale stamceller. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Transplantasjon av MSC til skadede steder for å fremme regenerering av skadede celler har blitt grundig studert, og den terapeutiske effekten er tydelig. Transplantasjonen og påfølgende differensiering av MSC er rapportert å gjenopprette hørsel hos rotter med hørselstap indusert av 3-nitropropioninsyre13. Selv om Lee et al. anvendte MSCer på mennesker trans-venøst, oppnådde de ingen signifikant forbedring ihørselen 14. Inntil nylig ble nesten 12 eksperimenter utf?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av forskningsstipend (NRF-2018-R1D1A1B07050175, HURF-2017-66) fra National Research Foundation (NRF) i Korea og Hallym University Research Fund.
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referências
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

