في المختبر الوقت الفاصل التصوير بالخلايا الحية لاستكشاف هجرة الخلايا نحو جهاز كورتي
Summary
في هذه الدراسة، نقدم طريقة تصوير في الوقت الحقيقي باستخدام المجهر البؤري لمراقبة الخلايا تتحرك نحو الأنسجة التالفة عن طريق حضانة الجسم الحي السابق مع ظهارة القوقعة التي تحتوي على جهاز كورتي.
Abstract
لدراسة آثار الخلايا الجذعية المتوسطة (MSCs) على تجديد الخلايا وعلاجها ، تتعقب هذه الطريقة هجرة MSC والتغيرات المورفولوجية بعد الثقافة المشتركة مع ظهارة قوقعة. تم شل حركة عضو كورتي على غطاء بلاستيكي عن طريق الضغط على جزء من غشاء ريسنر المتولد أثناء التشريح. هاجرت MSCs المحصورة بواسطة أسطوانة زجاجية نحو ظهارة القوقعة عندما تمت إزالة الأسطوانة. لوحظ توطينها السائد في تعديل جهاز كورتي ، المنحاز في اتجاه مماثل لاتجاه الألياف العصبية. ومع ذلك، تم توطين بعض MSCs في منطقة الحويلجان وأظهرت شكلا ممدودا أفقيا. وبالإضافة إلى ذلك، زادت الهجرة إلى منطقة خلايا الشعر، وتغير مورفولوجيا MSCs إلى أشكال مختلفة بعد علاج الكاناميسين. في الختام، تشير نتائج هذه الدراسة إلى أن الزراعة المشتركة ل MSCs ذات ظهارة القوقعة ستكون مفيدة لتطوير العلاجات عن طريق زرع الخلايا ولدراسات تجديد الخلايا التي يمكن أن تفحص مختلف الحالات والعوامل.
Introduction
يمكن أن يحدث فقدان السمع خلقيا أو يمكن أن يكون سببه تدريجيا عدة عوامل، بما في ذلك الشيخوخة والأدوية والضوضاء. غالبا ما يصعب علاج فقدان السمع لأنه من الصعب للغاية استعادة ضعف الوظيفة بمجرد تلف خلايا الشعر المسؤولة عن السمع1. ووفقا لمنظمة الصحة العالمية، تشير التقديرات إلى أن 461 مليون شخص في جميع أنحاء العالم يعانون من فقدان السمع، وهو ما يمثل 6.1٪ من سكان العالم. ومن بين المصابين بفقدان السمع، هناك 93 في المائة من البالغين، و7 في المائة من الأطفال.
وقد جرت محاولة اتباع عدد من النهج لعلاج فقدان السمع؛ وتجدر الإشارة إلى أن نهج التجديد باستخدام مركبات الكربون الهيدروفلورية قد برز كعلاج واعد. عندما تتلف الأنسجة ، يتم إطلاق MSCs بشكل طبيعي في نظام الدورة الدموية وتهاجر إلى موقع الإصابة حيث تفرز جزيئات مختلفة لتشكيل بيئة دقيقة تعزز التجديد2. ومن ثم، من المهم تطوير طريقة لعلاج الأنسجة التالفة من خلال هجرة MSCs المزروعة خارجيا لاستهداف الأعضاء وإفرازها اللاحق للجزيئات التي تسبب تنظيم المناعة القوية، وتولد الأوعية، ومكافحة موت الخلايا المبرمج لتعزيز استعادةوظيفةالخلية التالفة 3،4،5.
وقد تكون عملية التوجيه التي تهاجر فيها مركبات الكربون الهيدروفلورية إلى الأنسجة التالفة أهم عقبة يتعين التغلب عليها. لدى MSCs آلية توجيه نظامية مع خطوات متتالية من الربط / المتداول ، والتنشيط ، والاعتقال ، والهجرة / diapedesis ، والهجرة6،7،8. وتبذل حاليا جهود لتحديد سبل تحسين هذه الخطوات. استراتيجيات مختلفة، بما في ذلك التعديل الوراثي، هندسة سطح الخلية، فتيلة في المختبر، والتوجيه المغناطيسي، وقد تم اختبار6،7. وبالإضافة إلى ذلك، بذلت عدة محاولات لتعزيز حماية وتجديد خلايا الشعر السمعية عن طريق توجيه MSCs إلى موقع القوقعة التالفة. ومع ذلك ، فإن تتبع MSCs في الجسم الحي يستغرق وقتا طويلا ويتطلب عمالة كثيفة ويتطلب مهارات عالية التخصص9.
لحل هذه المشكلة، تم تطوير طريقة لمراقبة توجيه MSCs في القوقعة من خلال المجهر الكونفوجال الفاصل الزمني الذي يصور هجرة الخلايا على مدى عدة ساعات(الشكل 1). وقد تم تطويره في أوائلالقرن العشرين وأصبح مؤخرا أداة قوية لدراسة هجرة خلايا محددة.
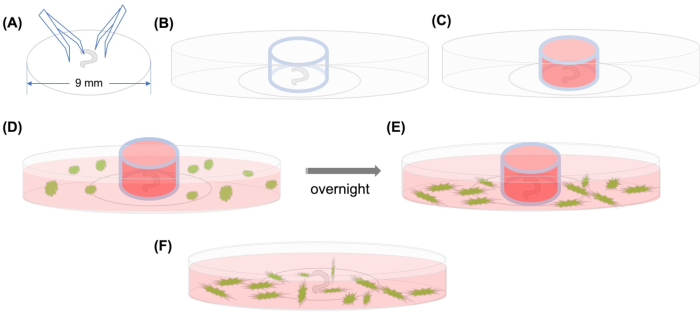
الشكل 1: تجريدي رسومية. (أ) بعد أن يتم الالتزام بالعضو تشريح كورتي على غطاء بلاستيكي باستخدام ملقط، يتم وضع غطاء على طبق مجهري 35 ملم زجاجي القاع، و (ب) يتم وضع اسطوانة الزجاج. (ج)بعد ملء داخل الاسطوانة الزجاجية مع المتوسطة،(D)يتم إضافة MSCs GFP المسمى مع المتوسطة بعناية خارج الاسطوانة. (ه) بعد الحضانة بين عشية وضحاها ، (واو) تتم إزالة اسطوانة الزجاج ، ويتم التقاط الصور مع المجهر confocal. الاختصارات: GFP = بروتين فلوري أخضر. MSCs = الخلايا الجذعية المتوسطة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
وقد تمت دراسة زرع MSCs في المواقع المتضررة لتعزيز تجديد الخلايا التالفة على نطاق واسع ، والتأثير العلاجي واضح. وقد أفيد زرع والتمايز اللاحقة من MSCs لاستعادة السمع في الفئران مع فقدان السمع الناجم عن حمض 3 نيتروبروبيونيك13. على الرغم من أن لي وآخرون تطبيق MSCs على البشر عبر الوريد، ف?…
Declarações
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من خلال المنح البحثية (NRF-2018-R1D1A1B07050175، HURF-2017-66) من المؤسسة الوطنية للبحوث (NRF) في كوريا وصندوق أبحاث جامعة هاليم.
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referências
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

