इन विट्रो टाइम-लैप्स लाइव-सेल इमेजिंग कॉर्टी के अंग की ओर सेल माइग्रेशन का पता लगाने के लिए
Summary
इस अध्ययन में, हम कॉन्फोकल माइक्रोस्कोपी का उपयोग करके एक वास्तविक समय इमेजिंग विधि प्रस्तुत करते हैं ताकि पूर्व वीवो इनक्यूबेशन द्वारा कॉर्टी के अंग वाले कॉकलियर एपिथेलियम के साथ क्षतिग्रस्त ऊतकों की ओर बढ़ने वाली कोशिकाओं का निरीक्षण किया जा सके।
Abstract
सेल पुनर्जनन और उपचार पर मेसेंचिमल स्टेम सेल (एमएससी) के प्रभावों का अध्ययन करने के लिए, यह विधि कॉकलियर एपिथेलियम के साथ सह-संस्कृति के बाद एमएससी माइग्रेशन और रूपात्मक परिवर्तनों को ट्रैक करती है। कॉर्टी के अंग को विच्छेदन के दौरान उत्पन्न रिस्नर की झिल्ली के एक हिस्से को दबाकर प्लास्टिक कवरलिप पर स्थिर किया गया था। एक ग्लास सिलेंडर द्वारा सीमित एमएससी जब सिलेंडर हटा दिया गया था कॉकलियर एपिथेलियम की ओर चले गए । उनका प्रमुख स्थानीयकरण कॉर्टी के अंग के मोडिओलस में देखा गया था, जो तंत्रिका फाइबर के समान दिशा में गठबंधन किया गया था। हालांकि, कुछ एमएससी को लिम्बस क्षेत्र में स्थानीयकृत किया गया था और एक क्षैतिज विस्तारित आकार दिखाया गया था। इसके अलावा हेयर सेल एरिया में माइग्रेशन बढ़ा और कानामाइसिन ट्रीटमेंट के बाद एमएससी की मॉर्फोलॉजी विभिन्न रूपों में बदल गई। अंत में, इस अध्ययन के परिणामों से संकेत मिलता है कि कॉकलियर एपिथेलियम के साथ एमएससी की सहसंस्कृति कोशिका प्रत्यारोपण के माध्यम से चिकित्सीय के विकास के लिए और सेल पुनर्जनन के अध्ययन के लिए उपयोगी होगी जो विभिन्न स्थितियों और कारकों की जांच कर सकती है।
Introduction
सुनवाई हानि सौहार्दपूर्ण ढंग से हो सकती है या उम्र बढ़ने, दवाओं और शोर सहित कई कारकों द्वारा उत्तरोत्तर कारण हो सकती है। श्रवण हानि का इलाज करना अक्सर कठिन होता है क्योंकि एक बार श्रवण के लिए उत्तरदायी बाल कोशिकाओं के क्षतिग्रस्त होने के बाद बिगड़ा कार्य को बहाल करना बहुत चुनौतीपूर्ण होता है1. विश्व स्वास्थ्य संगठन के अनुसार, दुनिया भर में ४६१,०,० लोगों को सुनवाई हानि का अनुमान है, जो दुनिया की आबादी का ६.१% के लिए खातों । सुनवाई हानि के साथ उन में से, ९३% वयस्क हैं, और 7% बच्चे हैं ।
कई दृष्टिकोणों को सुनवाई हानि का इलाज करने का प्रयास किया गया है; विशेष रूप से, एमएससी का उपयोग करके एक पुनर्जनन दृष्टिकोण एक आशाजनक उपचार के रूप में उभरा है। जब ऊतक क्षतिग्रस्त हो जाता है, तो एमएससी को स्वाभाविक रूप से संचार प्रणाली में छोड़ा जाता है और चोट स्थल पर स्थानांतरित कर दिया जाता है जहां वे विभिन्न अणुओं को एक माइक्रोएनवायरमेंट बनाने के लिए स्रावित करते हैं जो पुनर्जनन2को बढ़ावा देता है। इसलिए,क्षतिग्रस्त कोशिका समारोह3,4,5की बहाली को बढ़ाने के लिए बाहरी रूप से प्रत्यारोपित एमएससी के प्रवास के माध्यम से क्षतिग्रस्त ऊतकों के इलाज के लिए एक विधि विकसित करना महत्वपूर्ण है जो अंगों को लक्षित करने के लिए और अणुओं के उनके बाद के स्राव का कारण बनता है जो शक्तिशाली प्रतिरक्षा विनियमन, एंजियोजेनेसिस और एंटी-एपोप्टोसिस का कारण बनता है।
होमिंग प्रक्रिया जिसमें एमएससी क्षतिग्रस्त ऊतकों में स्थानांतरित होते हैं, दूर करने के लिए सबसे महत्वपूर्ण बाधा हो सकती है। एमएससी में टेदरिंग/रोलिंग, एक्टिवेशन, गिरफ्तारी,ट्रांसफ्यूजन/डायपेडेसिस और माइग्रेशन6,7,8के अनुक्रमिक कदमों के साथ एक प्रणालीगत होमिंग तंत्र है । वर्तमान में, इन कदमों को बेहतर बनाने के तरीकों की पहचान करने के प्रयास चल रहे हैं । आनुवंशिक संशोधन, सेल सरफेस इंजीनियरिंग, इन विट्रो प्राइमिंग और चुंबकीय मार्गदर्शन सहित विभिन्न रणनीतियों का परीक्षण किया गया है6,7। इसके अलावा, क्षतिग्रस्त कोचलिया की साइट पर एमएससी होमिंग द्वारा श्रवण बाल कोशिकाओं के संरक्षण और उत्थान को बढ़ावा देने के लिए कई प्रयास किए गए हैं । हालांकि, वीवो में एमएससी पर नज़र रखने में समय लेने वाली और श्रम-प्रधान है और इसके लिए अत्यधिक विशिष्ट कौशल9की आवश्यकता होती है।
इस समस्या को हल करने के लिए, समय-चूक कॉन्फोकल माइक्रोस्कोपी के माध्यम से कोकलिया में एमएससी के होमिंग का निरीक्षण करने के लिए एक विधि विकसित की गई थी जो कई घंटों(चित्र 1)से अधिक कोशिकाओं के प्रवास की तस्वीरों को चित्रित करती है। यह 20वीं शताब्दी की शुरुआत में विकसित किया गया था और हाल ही में विशिष्ट कोशिकाओं के प्रवास का अध्ययन करने के लिए एक शक्तिशाली उपकरण बन गया है।
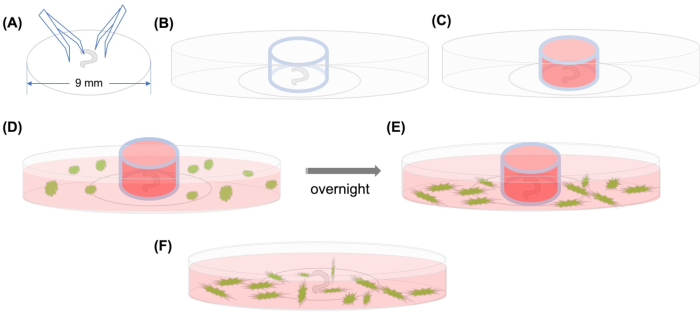
चित्र 1:ग्राफिकल सार। (ए)कॉर्टी के विच्छेदित अंग का पालन करने के बाद एक प्लास्टिक कवरलिप पर संदंश का उपयोग करके, कवरस्लिप को 35 मिमी ग्लास-तली कॉन्फोकल माइक्रोस्कोपिक डिश पर रखा जाता है, और(ख)ग्लास सिलेंडर तैनात किया जाता है। (ग)ग्लास सिलेंडर के अंदर मीडियम भरने के बाद(डी)जीएफपी लेबल वाले एमएससी को मीडियम के साथ सिलेंडर के बाहर सावधानी से जोड़ा जाता है । (ई)रातभर इनक्यूबेशन के बादग्लाससिलेंडर को हटा दिया जाता है, और इमेज को कॉन्फोकल माइक्रोस्कोप से लिया जाता है । संक्षिप्त रूप: जीएफपी = हरा फ्लोरोसेंट प्रोटीन; MSCs = mesenchymal स्टेम सेल। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
क्षतिग्रस्त कोशिकाओं के उत्थान को बढ़ावा देने के लिए क्षतिग्रस्त स्थलों में एमएससी के प्रत्यारोपण का बड़े पैमाने पर अध्ययन किया गया है, और चिकित्सीय प्रभाव स्पष्ट है । 3-नाइट्रोप्रोपोनिक एसिड1…
Declarações
The authors have nothing to disclose.
Acknowledgements
इस काम को कोरिया के नेशनल रिसर्च फाउंडेशन (एनआरएफ) और हैलिम यूनिवर्सिटी रिसर्च फंड से रिसर्च ग्रांट (एनआरएफ-2018-R1D1A1B0705050175, HURF-2017-66) का समर्थन मिला ।
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referências
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

