Imaging a cellule vive time-lapse in vitro per esplorare la migrazione cellulare verso l'organo di Corti
Summary
In questo studio, presentiamo un metodo di imaging in tempo reale utilizzando la microscopia confocale per osservare le cellule che si muovono verso il tessuto danneggiato mediante incubazione ex vivo con l’epitelio cocleare contenente l’organo di Corti.
Abstract
Per studiare gli effetti delle cellule staminali mesenchimali (CSC) sulla rigenerazione e sul trattamento cellulare, questo metodo tiene traccia della migrazione MSC e dei cambiamenti morfologici dopo la co-coltura con epitelio cocleare. L’organo di Corti è stato immobilizzato su un coverslip di plastica premendo una porzione della membrana del Reissner generata durante la dissezione. I CSC confinati da un cilindro di vetro migrarono verso l’epitelio cocleare quando il cilindro fu rimosso. La loro localizzazione predominante è stata osservata nel modiolo dell’organo di Corti, allineato in una direzione simile a quella delle fibre nervose. Tuttavia, alcuni CSC erano localizzati nell’area limbus e mostravano una forma allungata orizzontalmente. Inoltre, la migrazione nell’area delle cellule cieche è stata aumentata e la morfologia dei CSC è cambiata in varie forme dopo il trattamento con kanamicina. In conclusione, i risultati di questo studio indicano che la cocultura dei CSC con epitelio cocleare sarà utile per lo sviluppo di terapie attraverso il trapianto cellulare e per studi di rigenerazione cellulare in grado di esaminare varie condizioni e fattori.
Introduction
La perdita dell’udito può verificarsi congenitamente o può essere causata progressivamente da diversi fattori, tra cui invecchiamento, farmaci e rumore. La perdita dell’udito è spesso difficile da trattare perché è molto difficile ripristinare la funzione compromessa una volta che le cellule ciliate responsabili dell’udito sonodanneggiate 1. Secondo l’Organizzazione Mondiale della Sanità, si stima che 461 milioni di persone in tutto il mondo abbiano ipoacusia, che rappresenta il 6,1% della popolazione mondiale. Di coloro che hanno ipoacusia, il 93% sono adulti e il 7% sono bambini.
Sono stati tentati diversi approcci per trattare la perdita dell’udito; in particolare, un approccio di rigenerazione che utilizza i CTC è emerso come un trattamento promettente. Quando il tessuto è danneggiato, i CSC vengono naturalmente rilasciati nel sistema circolatorio e migrano verso il sito della lesione dove secernono varie molecole per formare un microambiente che promuove larigenerazione 2. Pertanto, è importante sviluppare un metodo per trattare i tessuti danneggiati attraverso la migrazione dei CBC impiantati esternamente agli organi bersaglio e la loro successiva secrezione di molecole che causano una potente regolazione immunitaria, angiogenesi e anti-apoptosi per migliorare il ripristino della funzionecellulare danneggiata 3,4,5.
Il processo di homing in cui i CSC migrano verso tessuti danneggiati può essere l’ostacolo più importante da superare. Gli MSC hanno un meccanismo sistemico di homing con passaggi sequenziali di tethering/rolling, attivazione, arresto, trasmigrazione/diapedesi e migrazione6,7,8. Attualmente sono in corso sforzi per individuare modi per migliorare questi passaggi. Varie strategie, tra cui la modificazione genetica, l’ingegneria delle superfici cellulari, l’adescamento in vitro e la guida magnetica,sono state testate 6,7. Inoltre, sono stati fatti diversi tentativi per promuovere la protezione e la rigenerazione delle cellule ciliate uditivi affinando i CTC nel sito della coclea danneggiata. Tuttavia, tenere traccia dei CSC in vivo richiede molto tempo e manodopera e richiede competenze altamente specializzate9.
Per risolvere questo problema, è stato messo a punto un metodo per osservare l’affinamento dei CFC nella coclizione attraverso la microscopia confocale time-lapse che fotografa la migrazione delle cellule per diverse ore (Figura 1). È stato sviluppato all’inizio del XX secoloed è recentemente diventato un potente strumento per studiare la migrazione di cellule specifiche.
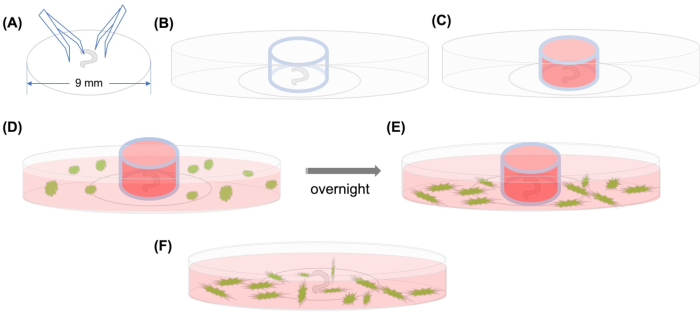
Figura 1: Astratto grafico. (A) Dopo che l’organo sezionato di Corti è stato aderito su un copripasta di plastica con forcep, il copripasta viene posizionato su un piatto microscopico confocale con fondo di vetro da 35 mm e (B) il cilindro di vetro è posizionato. (C) Dopo aver riempito l’interno del cilindro di vetro con CCC con etichetta GFP media,(D)con mezzo vengono aggiunti con attenzione all’esterno del cilindro. (E) Dopo l’incubazione durante la notte,(F)il cilindro di vetro viene rimosso e le immagini vengono scattate con un microscopio confocale. Abbreviazioni: GFP = proteina fluorescente verde; MSC = cellule staminali mesenchimali. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il trapianto di MBC in siti danneggiati per promuovere la rigenerazione delle cellule danneggiate è stato ampiamente studiato e l’effetto terapeutico è evidente. Il trapianto e la successiva differenziazione dei CSC sono stati segnalati per ripristinare l’udito nei ratti con perdita dell’udito indotta da acido 3-nitropropionico13. Sebbene Lee et al. Fino a poco tempo fa, quasi 12 esperimenti sono stati condotti per ripristinare l’udito nel modello di roditore mediante tra…
Declarações
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato da borse di ricerca (NRF-2018-R1D1A1B07050175, HURF-2017-66) della National Research Foundation (NRF) della Corea e del Fondo di ricerca universitaria Hallym.
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Referências
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

