Induktion av mikroströmning genom icke-sfäriska bubbosvängningar i ett akustiskt levitationssystem
Summary
En snabb och pålitlig teknik föreslås för att styra formsvängningarna hos en enda, fångad akustisk bubbla som är baserad på koalescensteknik mellan två bubblor. De symmetristyrda bubbelformoscillationerna i stabilt tillstånd möjliggör analys av vätskeflödet som genereras i närheten av bubbelgränssnittet.
Abstract
När de ligger nära biologiska barriärer kan oscillerande mikrobubblor öka cellmembranpermeabiliteten, vilket möjliggör läkemedels- och geninternalisering. Experimentella observationer tyder på att den tillfälliga permeabiliseringen av dessa barriärer kan bero på skjuvspänning som utövas på cellvävnader genom kavitationsmikrostreaming. Kavitation mikrostreaming är generering av virvelflöden som uppstår runt oscillerande ultraljud mikrobubblor. För att producera sådana vätskeflöden måste bubbesvängningar avvika från rent sfäriska svängningar och innefatta antingen translationell instabilitet eller formlägen. Experimentella studier av bubbelinducerade flöden och skjuvspänning på närliggande ytor är ofta begränsade i sin omfattning på grund av svårigheten att fånga formdeformationer av mikrobubblor på ett stabilt och kontrollerbart sätt. Vi beskriver utformningen av en akustisk levitationskammare för studier av symmetristyrda icke-sfäriska svängningar. Sådan kontroll utförs genom att använda en koalescensteknik mellan två närmande bubblor i ett tillräckligt intensivt ultraljudsfält. Kontrollen av icke-sfäriska svängningar öppnar vägen till en kontrollerad kavitationsmikroströmning av en fri ytoscillerande mikrobubbla. Kameror med hög bildhastighet gör det möjligt att undersöka kvasi-samtidigt den icke-sfäriska bubbeldynamiken vid den akustiska tidsskalan och vätskeflödet vid en lägre tidsskala. Det visas att en stor variation av vätskemönster kan erhållas och att de är korrelerade med det modala innehållet i bubbelgränssnittet. Vi visar att även de höga ordningens formlägen kan skapa vätskemönster över stora avstånd om gränssnittsdynamiken innehåller flera lägen, vilket belyser potentialen för icke-sfäriska svängningar för riktad och lokaliserad läkemedelsleverans.
Introduction
I medicin måste ett administrerat läkemedel tränga igenom många hinder i det levande systemet innan de når de önskade målen. De flesta läkemedel rengörs dock snabbt bort från blodomloppet. Målinriktningseffektiviteten är låg och de kan inte lätt korsa cellmembran, vilket leder till ineffektiv läkemedelsleverans. För närvarande har användningen av mikrobubblor i kombination med ultraljud föreslagits som en innovativ metod för icke-invasiv, exakt och riktad leverans av läkemedel och gener till patologiska vävnader och celler1. I detta tillvägagångssätt kan mikrobubblor spela en roll som bärare där fria läkemedel antingen injiceras tillsammans med en gasbubbelsuspension eller laddas på dess yta. Mikrobubblor kan också fungera som en lokal vektor för att fokusera ultraljudsenergin för att interagera med cellerna. I grund och botten, under ultraljudsexponering, komprimerar och expanderar bubblor stabilt, en regim som kallas stabil kavitation som genererar vätskeflöden och därmed skjuvspänning på närliggande föremål. Mikrobubblor kan också svänga icke-linjärt och expandera tills kollaps, i tröghetskavitationens regim, vilket ger chockvågor som sprider sig radiellt från kollapsplatsen2. Det har visats att kavitation, antingen stabil eller tröghet, förbättrar permeabiliseringen av cellmembran och därmed ökar internaliseringen av läkemedel i cellen3.
I terapeutiska tillämpningar är det mycket viktigt att förstå mekanismen för bubbelcellinteraktionen, men det finns flera hinder, både från vetenskapliga och tekniska sidor, som hindrar vår kunskap från att utvecklas. För det första är det mycket svårt att fånga cellernas dynamik som svar på bubbelinducerade mekaniska stimuli4. Vid den akustiska tidsskalan kan första ordningens mikrobubbelsvängningar leda till aktivering av membrankanaler, vilket underlättar molekylär passage över biologiska gränssnitt. Detta sker genom direkt svängning av cellmembranet, även kallat “cellulär massage”5. Kanalaktivering efter direkt mekanisk påfrestning visades med hjälp av patch-clamp-tekniker som mätte elektrofysiologiska egenskaper hos cellmembran under och efter ultraljudsexponering6. Mätning av bubbelinducerad celldynamik (vilket betyder det fullständiga fältet för deformation av cellmembranet) vid den akustiska tidsskalan skulle också ge insikter i tröskeln för membranområdesexpansion ΔA / A som krävs för att inducera porer i cellmembranet7. Den andra barriären är att kontrollera den kollapsande bubbelregimen för att undvika mikrobubbelinducerad celllys. Bubbelkollapser och inducerade mikrojetstrålar har identifierats som en mekanism genom vilken membranperforering sker 8,9. När det väl är permeabiliserat reparerar cellmembranet genom självförsegling av lipidskikten och fusion av intracellulära vesiklar9. Förekomsten av bubbelkollaps kan också orsaka dödliga skador på cellen och inducera onödiga biverkningar i de omgivande. I känsliga applikationer som ultraljudsmedierad öppning av blod-hjärnbarriären är det allmänt accepterat att tröghetsbubbelkollapser bör undvikas10.
Därför ägnas för närvarande stora ansträngningar åt utformningen av ultraljudsemissionssekvenser, i kombination med passiv kavitationsövervakning och kontroll, för att säkerställa stabila svängningar av mikrobubblor11. I denna stabila regim har det antagits att stabilt oscillerande bubblor spelar en stark roll i utlösningen av membranpermeabilisering genom att främja rumsligt riktad skjuvspänning på cellmembranet7. Skjuvspänningen är resultatet av vätskeflödena som skapas i närheten av de oscillerande bubblorna. Dessa flytande flöden kallas kavitation mikrostreaming, och, som nämnts ovan, de är en av de flera möjliga mekanismer som är ansvariga för ökat upptag av extracellulära molekyler. Vid hantering av suspension av bubblor eller celler såsom in vitro biologiska transfektionsanalyser12 kan permeabilisering genom mikrostreaming vara mycket effektivare än permeabilisering genom bubbelkollaps. Detta kan visas genom ett enkelt geometriskt övervägande. I cellsuspensioner kommer sonoporation att vara effektiv om majoriteten av de suspenderade cellerna utsätts för tillräckligt stora mekaniska effekter (vilket leder till membranpermeabilisering). Det är känt att bubbelkollapser riktas längs riktningen för isotrop symmetribrytning, såsom bubbelväggaxeln13 eller bubbelbubblan och bubbelcellinjen som förenar deras masscentrum14. Den producerade mikrojeten är därför ett rumsligt lokaliserat fenomen längs ett begränsat antal linjer som förbinder cell- och bubbelcentra. Beroende på cell- och bubbelkoncentrationen, liksom bubbelcellavståndet, kan denna effekt inte vara den mest effektiva för att permeabilisera hela antalet suspenderade celler. Däremot är kavitationsmikrostreaming ett fenomen som uppträder på en långsam tidsskala, med en stor rumslig expansion i jämförelse med bubbelradien. Dessutom fördelas vätskeflödet runt bubblan och kan därför påverka ett större antal celler, på ett mycket långt avstånd. Att förstå den genererade kavitationsmikroströmningen runt en oscillerande bubbla är därför en förutsättning för att kontrollera och kvantifiera den bubbelinducerade skjuvspänningen som appliceras på celler.
För att göra detta består ett preliminärt steg i att kontrollera de sfäriska och icke-sfäriska svängningarna hos en ultraljudsdriven bubbla, eftersom de genererade vätskeflödena induceras av bubbelgränssnittets rörelse15,16. I synnerhet måste formsvängningar av mikrobubblor utlösas och hållas stabila. Dessutom måste orienteringen av bubbelformsvängningarna kontrolleras för att korrekt analysera korrelationen mellan bubbelgränssnittsdynamiken och det inducerade mikroströmningsmönstret. När man sammanfattar den befintliga litteraturen är det uppenbart att detaljerade experimentella resultat av kavitationsinducerad mikroströmning endast är tillgängliga för bubblor fästa vid en yta. Väggfästa mikrobubblor används ofta för att bedöma noggrann gränssnittsdynamik och cellinteraktioner på mikrometerskala under ett ultrasnabbt mikroskopisystem. Denna konfiguration är terapeutiskt relevant när man överväger vibrerande mikrobubblor belägna på cellmembranet17,18,19. Studien av substratbunden bubbla kan dock göra analysen av bubbeldynamik mer komplicerad, delvis på grund av den komplexa karaktären hos kontaktlinjedynamik20 och utlösningen av asymmetriska formlägen21. I medicinska och biologiska tillämpningar finns bubblor som inte är fästa vid en vägg vanligtvis i begränsade geometrier som små kärl. Detta påverkar avsevärt bubbeldynamik och forminstabilitet. I synnerhet flyttar närvaron av en närliggande vägg trycktröskeln för formläge som utlöses till lägre tryckvärden beroende på formlägesnummer och bubbelstorlek22. Väggen påverkar också den bubbelinducerade mikroströmningen med möjligen högre intensitet för det producerade flödet23.
Bland alla möjliga scenarier som mikrobubblor kan uppleva (fria eller fästa, nära en vägg, kollapsande eller stabilt oscillating), föreslår vi att undersöka den icke-sfäriska dynamiken hos en enda bubbla långt ifrån någon gräns. Den experimentella uppställningen är baserad på ett akustiskt levitationssystem24 där en stående ultraljudsvåg används för att fånga bubblan. Detta scenario överensstämmer med medicinska tillämpningar där en samling suspenderade bubblor och celler samexisterar i en sonotransfektionskammare, till exempel. Så långt bubblor och celler inte är för nära, antas det att närvaron av en cell inte påverkar bubbelgränssnittsdynamiken. När celler följer de loopliknande banorna för kavitationsinducerad mikrostreaming, närmar de sig cykliskt och stöter bort från bubbelplatsen och vi kan anta att cellnärvaron varken påverkar strömningsmönstret eller dess medelhastighet. Dessutom är icke-sfärisk dynamik och inducerad mikroströmning från enstaka bubblor långt ifrån gränsen välkända ur teoretisk synvinkel. För att länka det bubbelinducerade vätskeflödet till bubbelkonturdynamiken är det nödvändigt att noggrant karakterisera bubbelgränssnittsdynamiken. För att göra detta är det att föredra att anpassa den spatiotemporala skalan i experimentella studier med avseende på de som används i terapier så att förvärv med vanliga höghastighetskameror (under 1 miljon bildrutor / sekund) är möjligt genom att använda stora bubblor exciterade vid lägre frekvenser. När man överväger obelagda bubblor är egenfrekvensen ω n för ett givet läge n relaterad till bubbelstorleken som 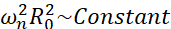 25. Detta radie-egenfrekvensförhållande modifieras något när man överväger skalade bubblor26, men storleksordningen för egenfrekvensen ωn förblir densamma. Således liknar undersökning av bubblor med jämviktsradier ~ 50 μm i ett 30 kHz ultraljudsfält att studera belagda bubblor med radier ~ 3 μm i ett 1,7 MHz-fält, som föreslagits av Dollet et al.27. Liknande formlägesnummer och därmed mikroströmningsmönster förväntas därför.
25. Detta radie-egenfrekvensförhållande modifieras något när man överväger skalade bubblor26, men storleksordningen för egenfrekvensen ωn förblir densamma. Således liknar undersökning av bubblor med jämviktsradier ~ 50 μm i ett 30 kHz ultraljudsfält att studera belagda bubblor med radier ~ 3 μm i ett 1,7 MHz-fält, som föreslagits av Dollet et al.27. Liknande formlägesnummer och därmed mikroströmningsmönster förväntas därför.
För att utlösa icke-sfäriska svängningar i bubbelgränssnittet är det nödvändigt att överskrida en viss trycktröskel som är radieberoende, såsom visas i figur 1. Befintliga experimentella tekniker bygger på ökningen av det akustiska trycket för att utlösa ytlägen (illustrerat med bana (1) i figur 1), antingen genom stegvis tryckökning28 eller genom excitation med modulerad amplitud som är ansvarig för periodisk start och utrotning av ytlägen29. De största nackdelarna med dessa tekniker är (i) en slumpmässig orientering av symmetriaxeln för ytsvängningarna som inte kan kontrolleras för att vara i bildplanet, (ii) en kort livslängd för bubbelformoscillationerna som gör analysen av de inducerade vätskeflödena svår vid större tidsskalor, och (iii) den frekventa utlösningen av instabila formlägen. Vi föreslår en alternativ teknik för att överskrida trycktröskeln vid ett konstant akustiskt tryck i radie-/tryckkartan, vilket illustreras av banan (2) i figur 1. För att göra det är det nödvändigt att öka bubbelstorleken så att den kommer att vara i instabilitetszonen. En sådan ökning utförs genom en bubbelkoalescensteknik. Koalescensen av två, initialt sfäriskt oscillande, mikrobubblor utnyttjas för att skapa en enda deformerad bubbla. Om det akustiska trycket och bubbelstorleken för den koalescenserade bubblan befinner sig i instabilitetszonen utlöses ytlägena. Vi bevisade också att koalescenstekniken inducerar stabila formsvängningar i en steady-state-regim, liksom en kontrollerad symmetriaxel definierad av den rätlinjiga rörelsen hos de två närmande bubblorna. Eftersom en stabil formoscillation säkerställs över minuter är analysen av bubbelinducerat vätskeflöde möjlig genom sådd av det flytande mediet med fluorescerande mikropartiklar, upplysta av ett tunt laserark. Genom att registrera rörelsen hos de fasta mikropartiklarna i närheten av bubbelgränssnittet kan man identifiera mönstret för det inducerade vätskeflödet30. Den övergripande principen för utlösning av bubbelformsvängningar, vilket leder till ett tidsstabilt vätskeflöde, illustreras i figur 2.
I följande protokoll beskriver vi de steg som krävs för att skapa stabila bubbelformsvängningar via koalescenstekniken och beskriver mätningarna av vätskeflödet. Detta inkluderar utformningen av det akustiska levitationssystemet, den akustiska kalibreringen, bubbelkärnbildning och koalescenstekniken, mätningen av bubbelgränssnittsdynamik och omgivande vätskeflöde samt bildbehandling.
Protocol
Representative Results
Discussion
Den presenterade proceduren består av att använda bubbelkoalescens för att utlösa symmetristyrda bubbelformoscillationer i steady-state, vilket möjliggör studier av det långsiktiga vätskeflödet inducerat av dessa svängningar. Den största utmaningen i tekniken är kontrollen av icke-sfäriska svängningar för en bubbla som fångas, långt ifrån några gränser.
De flesta av de befintliga teknikerna som föreslagits i litteraturen fokuserade på substratbundna bubblor <su…
Declarações
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av LabEx CeLyA vid universitetet i Lyon (ANR-10-LABX-0060 / ANR-11-IDEX-0007).
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
Referências
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

