神经元发育过程中的 ROS 活细胞成像
Summary
该协议描述了在培养斑马鱼神经元和幼虫中使用基因编码的过氧化氢(H2O2)生物传感器,以评估H2O2 在神经系统发育过程中的生理信号作用。它可以应用于不同的细胞类型,并修改与实验治疗研究活性氧物种(ROS)在一般发展。
Abstract
活性氧物种(ROS)是成熟的信号分子,在正常发育、平衡和生理学中非常重要。在不同的ROS中,过氧化氢(H2O2)在细胞信号中的作用最为突出。H2O2在若干物种的开发过程中被牵连。例如,在受精后的头几天,斑马鱼胚胎中检测到H2O2的瞬时增加。此外,消耗一个重要的细胞H2O2源,NADPH氧化酶(NOX),损害神经系统的发展,如分化,轴向生长,和视网膜结节细胞(RGCs)在体内和体外指导。在这里,我们描述了一种在发育过程中使用基因编码的H 2 O2-特异性生物传感器roGFP2-Orp1在培养斑马鱼神经元和整个幼虫中成像细胞内H 2O2水平的方法。这个探针可以在斑马鱼幼虫中短暂或稳定地表达。此外,由于基因表达或体积效应的差异,比例读数降低了检测伪证的可能性。首先,我们演示如何分离和培养从斑马鱼胚胎中衍生的RGC,这些胚胎暂时表达roGFP2-Orp1。然后,我们使用整个幼虫来监测H2O2水平在组织水平。传感器已通过添加 H2O2进行验证。此外,该方法还可用于通过产生具有组织特异性生物传感器表达的转基因动物来测量特定细胞类型和组织的 H2O2水平。由于斑马鱼促进遗传和发育操作,这里展示的方法可以作为测试H2O2在脊椎动物神经元和一般胚胎发育过程中的作用的管道。
Introduction
活性氧物种(ROS)信号调节神经系统的发展和功能1。一个重要的细胞ROS来源是NADPH氧化酶(NOX),这是产生超氧化物和过氧化氢(H 2 O2)2的跨膜蛋白。NOX酶存在于整个中枢神经系统(CNS)中,NOX衍生的ROS有助于神经元发育3、4、5、6。神经干细胞的维持和分化,建立神经元极性,中性生长,突触可塑性已被证明需要足够的ROS 7,8,9,10,11水平。另一方面,NOXs不受控制地生产ROS会导致神经退行性疾病,包括阿尔茨海默氏症、多发性硬化症和创伤性脑损伤12、13、14。因此,生产生理相关的ROS对于维持健康状况至关重要。
基因编码生物传感器的开发极大地促进了细胞ROS的检测。基因编码生物传感器的一个重要优点是 ROS 信号的时间和空间分辨率增加,因为这些传感器可以专门针对不同的位置。对氧化物敏感的GFP(roGFP)是一种类型的ROS生物传感器。roGFP2-Orp1变种通过其Orp1域专门检测H2O2,这是一种来自酵母15,16的谷胱甘肽过氧化物类家庭蛋白。Orp1蛋白的氧化被转移到roGFP2,以改变其构象(图1A)。探测器在405纳米和480纳米附近显示两个兴奋峰,在515纳米处显示一个单个发射峰值。氧化后,兴奋峰周围的荧光强度会发生变化:当405 nm兴奋增加时,480纳米激发会减少。因此,roGFP2-Orp1 是一种比值生物传感器,H2O2-水平通过两个不同波长的荧光增量(图 1B)的兴奋度比率检测到。总的来说,roGFP2-Orp1 是 ROS 成像的多功能工具,可在体内高效使用。
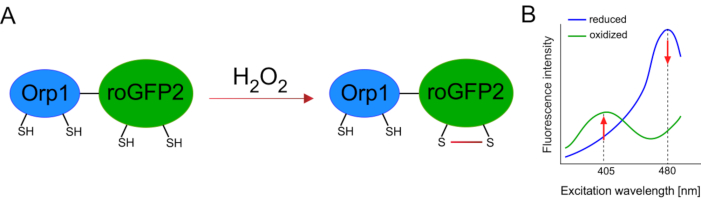
图1:roGFP2-Orp1. (A) 氧化剂转移的示意图表示和激发光谱发生在 Orp1 和 roGFP2 之间,以响应 H2O2,导致 roGFP2 的构象变化。(B) roGFP2-Orp1的激发光谱显示两个兴奋峰值在405 nm和480 nm和单个排放峰值在515 nm。H2O2氧化后,405 nm 激发增加,而 480 nm 激发减少。这会导致 H 2O 2存在的比例读出。该数字已从比兰和贝卢索夫(2017)16和摩根等人(2011)25修改。请单击此处查看此图的较大版本。
达尼奥雷里奥(斑马鱼)模型系统在应用基因编码生物传感器方面有几个优势。胚胎和幼虫的光学透明度使体内成像具有非侵入性。新的成像工具正在开发中,以实现更高的分辨率和更深的渗透17。此外,还有既定的基因操纵工具(异位mRNA表达,托尔2转基因等)和基因组编辑(塔伦斯,CRISPR/Cas9等),促进转基因动物的生成18。随着斑马鱼胚胎在母体之外发育,该系统进一步允许更容易地获取和操作胚胎。例如,单细胞阶段注射和药物治疗很容易做到。
在这里,我们使用斑马鱼通过注射体外转录的mRNA来暂时表达H2O2特异性生物传感器roGFP2-Orp1。这些胚胎可用于培养神经元的 体外 成像和 体内 成像(图2)。我们描述了从斑马鱼胚胎解剖和电镀视网膜结节细胞(RGCs)的协议,然后评估培养神经元的H2O2水平。然后,我们提出了一种利用共聚焦显微镜对罗格FP2-Orp1表达胚胎和幼虫进行 体内 成像的方法。这种方法不仅能够确定生理H2O2水平,而且还可以确定在不同的发育阶段或条件下发生的潜在变化。总的来说,该系统为检测活细胞和动物中的H2O2 提供了可靠的方法,以研究H2O2 在发育、健康和疾病中的作用。
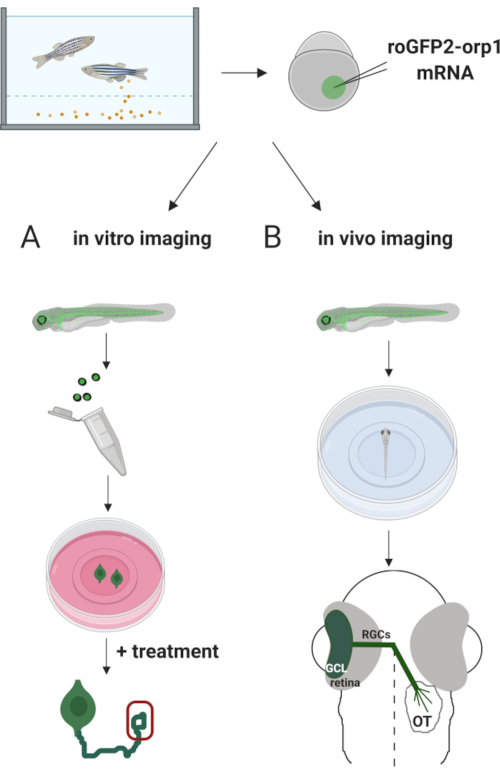
图2。实验方法大纲。简言之,胚胎采集后,roGFP2-Orp1 mRNA被注射到单细胞阶段斑马鱼胚胎的蛋黄中。发育中的胚胎可用于体外和体内成像的(A)和B。(A) GFP阳性胚胎用于解剖视网膜,用于在34马力下采集RGC。分离的 RGC 镀在 ZFCM (+) 介质中的 PDL/层膜盖上。生长锥成像可以进行RGC延长他们的轴突后,6-24小时的电镀。细胞可以接受不同的治疗,以测量H2O2水平的潜在变化。在这里,我们测量了RGC(红色)生长锥中的H 2 O2水平。(B) GFP阳性胚胎用于体内成像。在理想年龄,胚胎可以麻醉并安装在35毫米玻璃底盘上,用于共焦成像。在这里,胚胎被安装在腹膜成像的通风装置上。示意图显示斑马鱼的视网膜发育。RGC 形成结膜细胞层 (GCL),这是网状网膜的最内层。RGC轴突发展成视神经,穿过中线,形成视基亚西姆。然后,RGC轴突生长,在中脑的光学构造中形成突触。请单击此处查看此图的较大版本。
Protocol
Representative Results
Discussion
有几个关键步骤需要在整个协议中引起注意。我们相信,考虑到这些点将改善实验流。对于初级 RGC 培养,ZFCM(-) 的不育性非常重要,因为这种培养介质不含抗生素,在成像之前或成像期间可能发生污染。为了避免这种情况,我们建议仅在生物安全柜内准备和使用 ZFCM(-),并定期制作新鲜的 ZFCM(-) 介质(步骤 1.5)。此外,层压素库存应保持在-80°C。 解冻的层蛋白应随时储存在 4 °C。不要?…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项工作得到了国家卫生研究院(Grant R01NS1117701)、国家科学基金会(第1146944-IOS格兰特)、印第安纳创伤脊髓和脑损伤研究基金(格兰特20000289)、普渡研究基金会(格兰特·209911)和普渡大学研究与伙伴关系执行副总裁办公室(格兰特·210362)的支持。我们感谢科里·韦弗博士和海莉·罗德博士建立斑马鱼RGC文化协议。我们感谢海莉·罗德提供图4的数据。我们感谢利亚比亚西和肯尼 · 恩古恩对 Rgc 文化的帮助。我们感谢李将军编辑了文本。我们感谢托比亚斯·迪克博士为含有roGFP2-Orp1的PCS2+载体提供roGFP2-Orp1和邓青博士。图 2 是用 Biorender.com 创建的。
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
Referências
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

