Nöronal Gelişim Sırasında ROS Canlı Hücre Görüntüleme
Summary
Bu protokol, sinir sistemi gelişimi sırasında H 2 O2’ninfizyolojik sinyal rollerini değerlendirmek için kültürlü zebra balığı nöronlarında ve larvalarında genetik olarak kodlanmış bir hidrojen peroksit (H 2 O2)-biyosensör kullanımını açıklar. Farklı hücre tiplerine uygulanabilir ve genel gelişimde reaktif oksijen türlerini (ROS) incelemek için deneysel tedavilerle değiştirilebilir.
Abstract
Reaktif oksijen türleri (ROS), normal gelişim, homeostaz ve fizyolojide önemli olan iyi kurulmuş sinyal molekülleridir. Farklı ROS arasında, hidrojen peroksit (H2O2)hücresel sinyalizasyondaki rollerle karakterize edilir. H2O2, çeşitli türlerde gelişim sırasında bulaşmıştır. Örneğin, döllenmeyi takip eden ilk günlerde zebra balığı embriyolarındaH2 O2’de geçici bir artış tespit edilmiştir. Ayrıca, önemli bir hücresel H2O2 kaynağı olan NADPH oksidaz (NOX) tükendi, retinal ganglion hücrelerinin (RGC) hem in vivo hem de in vitrofarklılaşması, aksonal büyümesi ve rehberliği gibi sinir sistemi gelişimini bozar. Burada, genetik olarak kodlanmış H 2 O2 -spesifik biyosensör, roGFP2-Orp1 kullanılarak kültürlü zebra balığı nöronlarında ve tüm larvalarda hücre içi H2O2seviyelerini görüntüleme için bir yöntem açıklıyoruz. Bu prob zebra balığı larvalarında geçici veya stably olarak ifade edilebilir. Ayrıca, oranmetrik okuma, diferansiyel gen ekspresyosu veya hacim etkileri nedeniyle eserleri tespit etme olasılığını azaltır. İlk olarak, geçici olarak roGFP2-Orp1 eksprese eden zebra balığı embriyolarından elde edilen RPC’lerin nasıl izole edildiğini ve kültürlendirılacağını gösteriyoruz. Daha sonra, doku seviyesinde H2O2 seviyelerini izlemek için tüm larvaları kullanırız. Sensör H2O2ilavesi ile doğrulanmıştır. Ek olarak, bu metodoloji dokuya özgü biyosensör ekspresyörü ile transgenik hayvanlar üreterek belirli hücre tiplerinde ve dokulardaH2 O2 seviyelerini ölçmek için kullanılabilir. Zebra balığı genetik ve gelişimsel manipülasyonları kolaylaştırdığı için, burada gösterilen yaklaşım, omurgalılarda nöronal ve genel embriyonik gelişim sırasında H2O2’nin rolünü test etmek için bir boru hattı görevi görebilir.
Introduction
Reaktif oksijen türleri (ROS) sinyali sinir sisteminin gelişimini ve işleyişini düzenler1. Önemli bir hücresel ROS kaynağı, süperoksit ve hidrojen peroksit (H2O 2 )2üreten transmembran proteinleri olan NADPH oksidazlarıdır (NOX). NOX enzimleri merkezi sinir sistemi (CNS) boyunca bulunur ve NOX türevi ROS nöronal gelişime katkıda bulunur3,4,5,6. Sinirsel kök hücrelerin bakımı ve farklılaşması, nöronal polaritenin kurulması, neurit büyümesi ve sinaptik plastisitenin yeterli ROS7, 8,9,10,11seviyelerini gerektirdiği gösterilmiştir. Öte yandan, NOX’ler tarafından kontrolsüz ROS üretimi Alzheimer Hastalığı, multipl skleroz ve travmatik beyin hasarı dahil olmak üzere nörodejeneratif bozukluklara katkıda bulunur12,13,14. Bu nedenle, fizyolojik olarak ilgili ROS üretimi sağlıklı koşulların korunması için kritik öneme sahiptir.
Genetik olarak kodlanmış biyosensörlerin geliştirilmesi hücresel ROS’un tespitini büyük ölçüde kolaylaştırmıştır. Genetik olarak kodlanmış biyosensörlerin önemli bir avantajı, ROS sinyalinin artan zamansal ve mekansal çözünürlüğüdür, çünkü bu sensörler özellikle farklı konumlara hedeflenebilir. Redoks duyarlı GFP (roGFP) bu tür ROS biyosensörlerinin bir türüdür. RoGFP2-Orp1 varyantı özellikle Maya15,16’dan glutatyon peroksitoksin aile proteini olan Orp1 etki alanı aracılığıyla H 2 O2’yi algılar. Orp1 proteininin oksidasyonu, konformasyonunu değiştirmek için roGFP2’ye aktarılır (Şekil 1A). Prob, 405 nm ve 480 nm’ye yakın iki heyecan zirvesi ve 515 nm’de tek bir emisyon zirvesi sergiliyor. Oksidasyon üzerine, heyecan zirvesi etrafındaki floresan yoğunluğu değişir: 405 nm heyecan artarken, 480 nm heyecan azalır. Bu nedenle, roGFP2-Orp1 oranmetrik bir biyosensördür ve H2O2-seviyeleri iki farklı dalga boyunda heyecanlanan floresan yoğunluklarının oranı ile tespit edilir (Şekil 1B). Genel olarak, roGFP2-Orp1, ROS görüntüleme için verimli bir şekilde kullanılabilecek çok yönlü bir araçtır vivo.
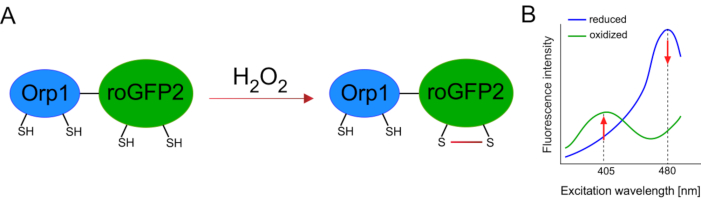
Şekil 1: RoGFP2-Orp1’in şematik gösterimi ve eksitasyon spektrumları. (A) Oksidan transferi, H 2 O 2’ye yanıt olarak Orp1 ve roGFP2 arasındagerçekleşirve roGFP2’de konformasyon değişikliklerine yol meydana gelir. (B) RoGFP2-Orp1’in heyecan spektrumu, 405 nm ve 480 nm’de iki heyecan zirvesi ve 515 nm’de tek emisyon zirvesi sergiler. H 2 O2ileoksidasyonüzerine, 405 nm ekscitasyon artarken 480 nm heyecan azalır. Bu, H2O2 varlığı için oranmetrik bir okuma ile sonuçlanır. Rakam Bilan ve Belousov (2017)16 ve Morgan ve ark. (2011)25‘ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Danio rerio (zebra balığı) model sistemi, genetik olarak kodlanmış biyosensörleri uygulamak için çeşitli avantajlara sahiptir. Embriyoların ve larvaların optik şeffaflığı invaziv olmayan in vivo görüntülemeyi mümkün hale sağlar. Daha yüksek çözünürlük ve daha derin penetrasyon elde etmek için yeni görüntüleme araçları geliştirilmektedir17. Ayrıca, transgenik hayvanların neslini destekleyen genetik manipülasyon (ektopik mRNA ekspresyözü, Tol2 transgenez, vb.) ve genom düzenleme (TALENler, CRISPR / Cas9, vb.) için yerleşik araçlar vardır18. Zebra balığı embriyoları anne dışında geliştikçe, bu sistem embriyoların daha kolay erişmesini ve manipülasyonuna izin verir. Örneğin, tek hücreli aşama enjeksiyonları ve ilaç tedavileri kolayca yapılabilir.
Burada zebra balığını, H 2 O2’yeözgü biyosensör roGFP2-Orp1’i tüp bebekli mRNA enjekteederekgeçici olarak ifade etmek için kullandık. Bu embriyolar hem kültürlü nöronların in vitro görüntülemesi hem de in vivo görüntüleme için kullanılabilir ( Şekil2). Zebra balığı embriyolarından retinal ganglion hücrelerinin (RGC) parçalanıp kaplatılmasını ve ardından kültürlü nöronlarda H2O2seviyelerinin değerlendirilmesini içeren bir protokol açıklıyoruz. Daha sonra konfokal mikroskopi kullanarak roGFP2-Orp1 ekspresyaklı embriyo ve larvaların in vivo görüntüleme yöntemi sunuyoruz. Bu yaklaşım sadece fizyolojik H2O2seviyelerinin belirlenmesine izin vermekle kalmaz, aynı zamanda farklı gelişim aşamalarında veya koşullarında meydana gelen potansiyel değişiklikleri de belirler. Genel olarak, bu sistem H 2 O2’ningelişim, sağlık ve hastalıktaki rolünü incelemek için canlı hücrelerde ve hayvanlarda H2O2’yi tespit etmek için güvenilir bir yöntem sağlar.
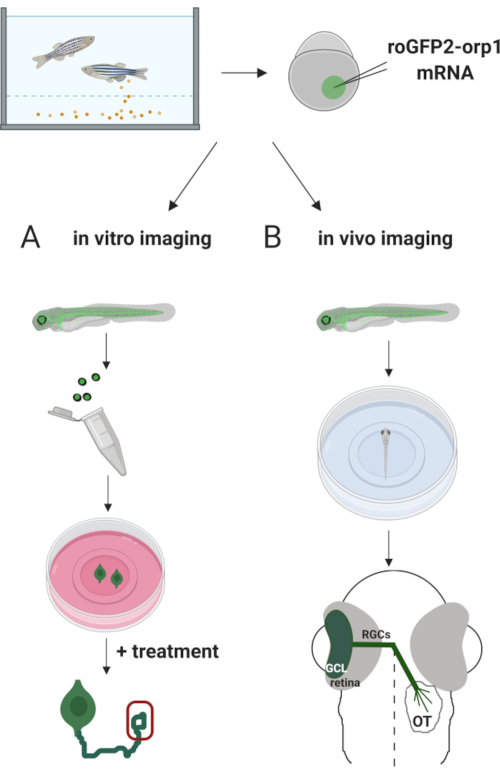
Şekil 2. Deneysel yaklaşımın ana hatları. Kısaca embriyo toplanmasından sonra roGFP2-Orp1 mRNA tek hücreli evre zebra balığı embriyolarının sarısına enjekte edilir. Gelişmekte olan embriyolar hem (A) in vitro hem de (B) in vivo görüntüleme için kullanılabilir. (A) GFP pozitif embriyolar 34 hpf’de RGC koleksiyonu için retinaları parçalamak için kullanılır. Ayrışmış RFC’ler ZFCM (+) ortamlarında PDL/laminin kaplı coverlips üzerine kaplanmıştır. RGC’ler 6-24 saat kaplamadan sonra aksonlarını uzattıkça büyüme konisi görüntülemesi yapılabilir. Hücreler, H2O2seviyelerindeki olası değişiklikleri ölçmek için farklı tedavilere tabi tutulabilir. Burada RGC’lerin (kırmızı) büyüme konilerindeH2 O2seviyelerini ölçtük. (B) In vivo görüntüleme için GFP pozitif embriyolar kullanılır. İstenilen yaşta embriyolar uyuşturulabilir ve konfokal görüntüleme için 35 mm cam dip yemeklerine monte edilebilir. Burada embriyolar retina görüntüleme için ventral olarak monte edilir. Şematik zebra balıklarında retina gelişimini gösterir. RGC’ler retinadaki en iç katman olan ganglion hücre tabakasını (GCL) oluşturur. RGC aksonları orta çizgiyi geçmek için optik sinire dönüşür ve optik chiasm oluşturur. Daha sonra, RGC aksonları, orta beyindeki optik tectum’da sinaps yapmak için dorsally büyür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu protokol boyunca dikkat etmeniz gereken birkaç kritik adım vardır. Bu noktaların göz önünde bulundurulmasının deneysel akışı iyileştireceğine inanıyoruz. Birincil RGC kültürü için, ZFCM’nin (-) sterilitesi çok önemlidir, çünkü bu kültür ortamı antibiyotik içermez ve görüntülemeden önce veya görüntüleme sırasında kontaminasyon oluşabilir. Bundan kaçınmak için, ZFCM’yi (-) yalnızca bir biyogüvenlik kabini içinde hazırlamanızı ve kullanmanızı ve düzenli olarak taze ZFCM (…
Declarações
The authors have nothing to disclose.
Acknowledgements
Bu çalışma Ulusal Sağlık Enstitüleri (Grant R01NS117701), Ulusal Bilim Vakfı (Grant 1146944-IOS), Indiana Travmatik Omurilik ve Beyin Hasarı Araştırma Fonu (Grant 20000289), Purdue Araştırma Vakfı (Grant 209911) ve Purdue Üniversitesi Araştırma ve Ortaklıklardan Sorumlu Başkan Yardımcısı Ofisi (Grant 210362) tarafından desteklendi. Dr. Cory J. Weaver ve Haley Roeder’a zebra balığı RGC kültür protokolünü oluşturdukları için teşekkür ederiz. Haley Roeder’a Şekil 4’ün verilerini sağladığı için ayrıca teşekkür ederiz. Leah Biasi ve Kenny Nguyen’e RGC kültürüne yardımları için teşekkür ederiz. Gentry Lee’ye metni düzenlediği için teşekkür ederiz. RoGFP2-Orp1 içeren pCS2+ vektörü için roGFP2-Orp1 ve Dr. Qing Deng sağladığı için Dr. Tobias Dick’e teşekkür ederiz. Şekil 2 Biorender.com ile oluşturulur.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
Referências
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

