Préparation des mousses de chitine expansée et leur utilisation dans l’élimination du cuivre aqueux
Summary
Cette étude décrit une méthode pour étendre la chitine dans une mousse par des techniques chimiques qui ne nécessitent aucun équipement spécialisé.
Abstract
La chitine est un biopolymère sous-exprité, naturellement abondant, mécaniquement robuste et chimiquement résistant. Ces qualités sont souhaitables dans un adsorbant, mais la chitine n’a pas la surface spécifique nécessaire et sa modification implique des techniques et des équipements spécialisés. On y décrit une nouvelle procédure chimique pour étendre les flocons de chitine, dérivés de déchets de coquilles de crevettes, en mousses de surface plus élevée. Le processus repose sur l’évolution du gazH2 à partir de la réaction de l’eau avec le NaH piégé dans un gel de chitine. La méthode de préparation ne nécessite aucun équipement spécialisé. La diffraction des rayons X de la poudre et la N2-physisorption indiquent que la taille de la cristallite diminue de 6,6 nm à 4,4 nm et que la surface spécifique augmente de 12,6 ± 2,1 m2/g à 73,9 ± 0,2 m2/g. Cependant, la spectroscopie infrarouge et l’analyse thermogravimétrique indiquent que le processus ne modifie pas l’identité chimique de la chitine. La capacité d’adsorption spécifique de Cu de la chitine expansée augmente proportionnellement à la surface spécifique de 13,8 ± 2,9 mg/g à 73,1 ± 2,0 mg/g. Cependant, la capacité d’adsorption du Cu en tant que densité de surface reste relativement constante à une moyenne de 10,1 ± 0,8 atome/nm2, cequi ne suggère à nouveau aucun changement dans l’identité chimique de la chitine. Cette méthode offre les moyens de transformer la chitine en un matériau de surface plus élevée sans sacrifier ses propriétés souhaitables. Bien que la mousse de chitine soit décrite ici comme un adsorbant, elle peut être envisagée comme un support de catalyseur, un isolant thermique et un matériau structurel.
Introduction
La chitine est un biopolymère mécaniquement robuste et chimiquement inerte, juste deprès la cellulose en abondance naturelle1. C’est le composant majeur de l’exosquelette des arthropodes et des parois cellulaires des champignons et des levures2. La chitine est similaire à la cellulose, mais avec un groupe hydroxyle de chaque monomère remplacé par un groupe acétylamine(Figure 1A,B). Cette différence augmente la force de liaison hydrogène entre les chaînes polymères adjacentes et donne à la chitine sa résilience structurelle caractéristique et son inertie chimique2,3. En raison de ses propriétés et de son abondance, la chitine a suscité un intérêt industriel et académique important. Il a été étudié comme un échafaudage pour la croissance tissulaire4,5,6, comme un composant dans les matériaux composites7,8,9,10,11, et comme un support pour les adsorbants et les catalyseurs11,12,13,14. Sa stabilité chimique, en particulier, rend la chitine attrayante pour les applications d’adsorption qui impliquent des conditions inhospitalières pour les adsorbants courants14. De plus, l’abondance des groupes amines fait de la chitine un adsorbant efficace pour les ions métalliques15. Cependant, la protonation des groupes amines dans des conditions acides réduit la capacité d’adsorption métallique de la chitine16. Une stratégie réussie consiste à introduire des sites d’adsorption plus résistants à la protonation17,18. Au lieu de cela, on décrit ici une méthode simple pour augmenter la surface spécifique et, par conséquent, le nombre de sites d’adsorption dans la chitine.
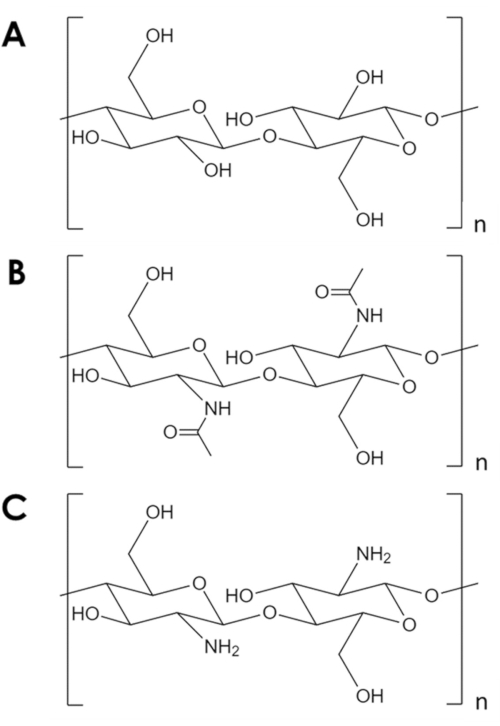
Graphique 1. Structure chimique. (A) cellulose, (B) chitine, (C) chitosane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Malgré ses nombreuses utilisations potentielles, la chitine est sous-utilisée. Le traitement de la chitine est difficile en raison de sa faible solubilité dans la plupart des solvants. Une limitation clé de son utilisation dans la catalyse et l’adsorption est sa faible surface spécifique. Alors que les supports typiques en carbone et en oxyde métallique ont des surfaces spécifiques de l’ordre10 2-10 3 m2/g, les flocons de chitine commerciaux ont des surfaces de l’ordre de 10 m2/g19,20,21. Des méthodes pour étendre la chitine en mousses existent, mais elles reposent invariablement sur des températures et des pressions élevées, des acides et des bases forts, ou des équipements spécialisés qui représentent une barrière d’entrée importante5,21,22,23,24,25. De plus, ces méthodes tendent à désacétyler la chitine pour former du chitosane(Figure 1C),un biopolymère plus soluble et réactif5,25,26.
Ici, une méthode est décrite pour étendre la chitine en mousses solides, augmenter sa surface spécifique et sa capacité d’adsorption, et maintenir son intégrité chimique. La méthode repose sur l’évolution rapide du gaz à partir d’un gel de chitine et ne nécessite aucun équipement spécialisé. L’augmentation de la capacité d’adsorption de la chitine expansée est démontrée avec le Cu2+aqueux – un contaminant commun dans les eaux souterraines locales26.
| Unité | Flocon soigné | Mousse cuite au four | Mousse lyophilisée | |
| Cristallinité | % | 88 | 74 | 58 |
| Taille du cristal | Nm | 6.5 | 4.4 | 4.4 |
| Surface | m2/g | 12,6 ± 2,1 | 43,1 ± 0,2 | 73,9 ± 0,2 |
| Absorption cu | mg/g | 13,8 ± 2,9 | 48,6 ± 1,9 | 73,1 ± 2,0 |
| Absorption cu | atome/nm2 | 10,5 ± 2,8 | 10,7 ± 0,4 | 9,4 ± 0,3 |
Tableau 1. Résumé des propriétés des matériaux. Les mousses de chitine ont une cristallinité et une taille de cristal plus faibles que les flocons de chitine propres. Cependant, la surface spécifique et l’absorption de Cu des mousses de chitine sont proportionnellement plus élevées que celles des flocons de chitine soignés.
Protocol
Representative Results
Discussion
La méthode proposée pour la fabrication de mousse de chitine permet la production de telles mousses sans avoir besoin d’équipement ou de techniques spécialisés. La production de la mousse de chitine repose sur la suspension d’hydrure de sodium dans un sol-gel de chitine. Le contact avec l’eau de l’atmosphère induit la gélification de la matrice de chitine et l’évolution de l’hydrogène gazeux par décomposition de l’hydrure de sodium. Par conséquent, les étapes critiques de la préparation sont (1…
Declarações
The authors have nothing to disclose.
Acknowledgements
La recherche a été parrainée par le Laboratoire de recherche de l’Armée du Commandement du développement des capacités de combat (numéro d’entente de coopération W911NF-15-2-0020). Toutes les opinions, constatations et conclusions, ou recommandations exprimées dans ce document sont celles des auteurs et ne reflètent pas nécessairement les points de vue du Laboratoire de recherche de l’Armée.
Nous remercions le Center for Advanced Materials Processing (CAMP) de l’Université technologique du Montana pour l’utilisation de certains des équipements spécialisés requis dans cette étude. Nous remercions également Gary Wyss, Nancy Oyer, Rick LaDouceur, John Kirtley et Katherine Zodrow pour leur assistance technique et leurs discussions utiles.
Materials
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
Referências
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658 (2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690 (2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114 (2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. . Naturally sourced chitin foam. , (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528 (2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH’s Water Treatment. , 1117 (2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -. C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).

