Identifizierung der Bindungsproteine kleiner Liganden mit der differentiellen radialen Kapillarwirkung des Ligandenassays (DRaCALA)
Summary
Der Differential Radial Capillary Action of Ligand Assay (DRaCALA) kann verwendet werden, um kleine ligandenbindende Proteine eines Organismus unter Verwendung einer ORFeome-Bibliothek zu identifizieren.
Abstract
In den letzten zehn Jahren gab es enorme Fortschritte beim Verständnis kleiner Signalmoleküle in der bakteriellen Physiologie. Insbesondere die Zielproteine mehrerer nukleotid-abgeleiteter Sekundärbotenstoffe (NSMs) wurden systematisch identifiziert und in Modellorganismen untersucht. Diese Erfolge sind hauptsächlich auf die Entwicklung mehrerer neuer Techniken zurückzuführen, darunter die Capture-Compound-Technik und die differentielle radiale Kapillarwirkung des Ligandenassays (DRaCALA), mit denen Zielproteine dieser kleinen Moleküle systematisch identifiziert wurden. Dieser Artikel beschreibt die Verwendung der NSMs, Guanosinpenta- und Tetraphosphate (p)ppGpp, als Beispiel und Videodemonstration der DRaCALA-Technik. Unter Verwendung von DRaCALA wurden 9 von 20 bekannten und 12 neuen Zielproteinen von (p)ppGpp im Modellorganismus Escherichia coli K-12 identifiziert, was die Leistungsfähigkeit dieses Assays demonstriert. Prinzipiell könnte DRaCALA zur Untersuchung kleiner Liganden verwendet werden, die durch radioaktive Isotope oder Fluoreszenzfarbstoffe markiert werden können. Die kritischen Schritte, Vor- und Nachteile von DRaCALA werden hier für die weitere Anwendung dieser Technik diskutiert.
Introduction
Bakterien verwenden mehrere kleine Signalmoleküle, um sich an sich ständig ändernde Umgebungen anzupassen1,2. Zum Beispiel vermitteln die Autoinduzierer, N-Acylhomoserinlactone und ihre modifizierten Oligopeptide, die interzelluläre Kommunikation zwischen Bakterien, um das Populationsverhalten zu koordinieren, ein Phänomen, das als Quorum Sensing bekanntist 2. Eine weitere Gruppe kleiner Signalmoleküle sind die NSMs, darunter das umfassend untersuchte zyklische Adenosinmonophosphat (cAMP), cyclisches Di-AMP, cyclisches Di-Guanosinmonophosphat (cyclisches Di-GMP) und Guanosin-Penta- und Tetraphosphate (p)ppGpp1. Bakterien produzieren diese NSMs als Reaktion auf eine Vielzahl von verschiedenen Stressbedingungen. Einmal produziert, binden diese Moleküle an ihre Zielproteine und regulieren mehrere verschiedene physiologische und metabolische Wege, um den angetroffenen Belastungen standzuhalten und das Überleben der Bakterien zu verbessern. Daher ist die Identifizierung der Zielproteine eine unumgängliche Voraussetzung, um die molekularen Funktionen dieser kleinen Moleküle zu entschlüsseln.
In den letzten zehn Jahren gab es einen Wissensboom über diese kleinen Signalmoleküle, hauptsächlich aufgrund mehrerer technischer Innovationen, die die Zielproteine dieser kleinen Moleküle enthüllten. Dazu gehören die Capture-Compound-Technik3,4,5und die differentielle radiale Kapillarwirkung des Ligandenassays (DRaCALA)6, die in diesem Artikel diskutiert werden soll.
DRaCALA wurde 2011 von Vincent Lee und Mitarbeitern6erfunden und nutzt die Fähigkeit einer Nitrocellulosemembran, freie und proteingebundene Liganden differentiell zu sequestriert. Moleküle wie Proteine können nicht auf einer Nitrocellulosemembran diffundieren, während kleine Liganden wie die NSMs dazu in der Lage sind. Durch Mischen des NSM (z. B., ppGpp) mit dem zu testenden Protein und Aufträgen auf der Membran sind zwei Szenarien zu erwarten (Abbildung 1): Wenn (p)ppGpp an das Protein bindet, wird das radioaktiv markierte (p)ppGpp vom Protein in der Mitte des Flecks zurückgehalten und diffundiert nicht nach außen, wodurch ein intensiver kleiner Punkt (d.h. B. starkes radioaktives Signal) unter einem Phosphorimager. Wenn (p)ppGpp jedoch nicht an das Protein bindet, diffundiert es frei nach außen, um einen großen Fleck mit gleichmäßigem radioaktivem Hintergrundsignal zu erzeugen.
Darüber hinaus kann DRaCALA die Wechselwirkung zwischen einem kleinen Molekül und einem ungereinigten Protein in einem ganzen Zelllysat nachweisen, wenn das Protein in ausreichender Menge vorhanden ist. Diese Einfachheit ermöglicht die Verwendung von DRaCALA bei der schnellen Identifizierung von Proteinzielen mithilfe einer ORFeome-Expressionsbibliothek. Tatsächlich wurden Zielproteine von cAMP7, cyclischem di-AMP8, cyclischem di-GMP9,10und (p)ppGpp11,12,13 systematisch unter Verwendung von DRaCALA identifiziert. Dieser Videoartikel verwendet (p)ppGpp als Beispiel, um die kritischen Schritte und Überlegungen bei der Durchführung eines erfolgreichen DRaCALA-Screenings zu demonstrieren und zu beschreiben. Es wird dringend empfohlen, eine ausführlichere Beschreibung von DRaCALA14 in Kombination mit diesem Artikel zu lesen, bevor Sie DRaCALA durchführen.
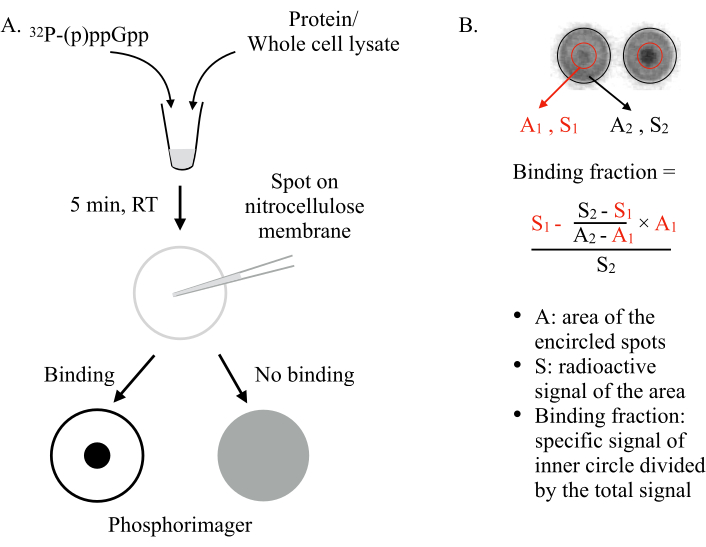
Abbildung 1: Das Prinzip von DRaCALA. (A) Schematische Darstellung des DRaCALA-Assays. Weitere Informationen finden Sie im Text. (B) Quantifizierung und Berechnung des Bindungsanteils. Weitere Informationen finden Sie im Text. Kurz gesagt, die DRaCALA-Flecken werden analysiert, indem zwei Kreise gezeichnet werden, die den gesamten Fleck und den inneren dunklen Punkt(dhdas zurückgehaltene (p) ppGpp aufgrund der Bindung des getesteten Proteins) umschreiben. Das spezifische Bindungssignal ist das radioaktive Signal des inneren Kreises (S1) nach Subtraktierung des unspezifischen Hintergrundsignals (berechnet durch A1 × ((S2 -S1)/(A2-A1))). Der Bindungsanteil ist das spezifische Bindungssignal dividiert durch das gesamte radioaktive Signal (S2). Abkürzungen: DRaCALA = Differential Radial Capillary Action of Ligand Assay; (p)ppGpp = Guanosinpenta- und Tetraphosphate; RT = Raumtemperatur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Einer der kritischen Schritte bei der Durchführung eines DRaCALA-Screenings besteht darin, gute Lysate ganzer Zellen zu erhalten. Zunächst sollten die getesteten Proteine in großen Mengen und in löslichen Formen hergestellt werden. Zweitens sollte die Lyse der Zellen vollständig sein und die Viskosität des Lysats muss minimal sein. Die Einbeziehung von Lysozym und die Verwendung von drei Gefrier-Tau-Zyklen reichen oft aus, um Zellen vollständig zu lysieren. Die freigesetzte chromosomale DNA macht das Lysat jedoch …
Declarações
The authors have nothing to disclose.
Acknowledgements
Die Arbeit wird durch einen NNF-Projektzuschuss (NNF19OC0058331) für YEZ und das Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Marie Skłodowska-Curie-Finanzhilfevereinbarung (Nr. 801199) an MLS unterstützt.

Materials
| 32P-α-GTP | Perkinelmer | BLU006X250UC | |
| 96 x pin tool | V&P Scientific | VP 404 | 96 Bolt Replicator, on 9 mm centers, 4.2 mm Bolt Diameter, 24 mm long |
| 96-well V-bottom microtiter plate | Sterilin | MIC9004 | Sterilin Microplate V Well 611V96 |
| Agar | OXOID – Thermo Fisher | LP0011 | Agar no. 1 |
| ASKA collection strain | NBRP, SHIGEN, JAPAN | Ref: DNA Research, Volume 12, Issue 5, 2005, Pages 291–299. https://doi.org/10.1093/dnares/dsi012 | |
| Benzonase | SIGMA | E1014-25KU | genetically engineered endonuclease from Serratia marcescens |
| Bradford Protein Assay Dye | Bio-Rad | 5000006 | Reagent Concentrate |
| DMSO | SIGMA | D8418 | ≥99.9% |
| DNase 1 | SIGMA | DN25-1G | |
| gel filtration10x300 column | GE Healthcare | 28990944 | contains 20% ethanol as preservative |
| Glycerol | PanReac AppliChem | 122329.1214 | Glycerol 87% for analysis |
| Hypercassette | Amersham | RPN 11647 | 20 x 40 cm |
| Imidazole | SIGMA | 56750 | puriss. p.a., ≥ 99.5% (GC) |
| IP Storage Phosphor Screen | FUJIFILM | 28956474 | BAS-MS 2040 20x 40 cm |
| Isopropyl β-d-1-thiogalactopyranoside (IPTG) | SIGMA | I6758 | Isopropyl β-D-thiogalactoside |
| Lysogeny Broth (LB) | Invitrogen – Thermo Fisher | 12795027 | Miller's LB Broth Base |
| Lysozyme | SIGMA | L4949 | from chicken egg white; BioUltra, lyophilized powder, ≥98% |
| MgCl2 (Magnesium chloride) | SIGMA | 208337 | |
| MilliQ water | ultrapure water | ||
| multichannel pipette | Thermo Scientific | 4661110 | F1 – Clip Tip; 1-10 ul, 8 x channels |
| NaCl | VWR Chemicals | 27810 | AnalaR NORMAPUR, ACS, Reag. Ph. Eur. |
| Ni-NTA Agarose | Qiagen | 30230 | |
| Nitrocellulose Blotting Membrane | Amersham Protran | 10600003 | Premium 0.45 um 300 mm x 4 m |
| PBS | OXOID – Thermo Fisher | BR0014G | Phosphate buffered saline (Dulbecco A), Tablets |
| PEG3350 (Polyethylene glycol 3350) | SIGMA | 202444 | |
| phenylmethylsulfonyl fluoride (PMSF) | SIGMA | 93482 | Phenylmethanesulfonyl fluoride solution – 0.1 M in ethanol (T) |
| Phosphor-imager | GE Healthcare | 28955809 | Typhoon FLA-7000 Phosphor-imager |
| Pipette Tips, filtered | Thermo Scientific | 94410040 | ClipTip 12.5 μl nonsterile |
| Poly-Prep Chromatography column | Bio-Rad | 7311550 | polypropylene chromatography column |
| Protease inhibitor Mini | Pierce | A32955 | Tablets, EDTA-free |
| screw cap tube | Thermo Scientific | 3488 | Microcentifuge Tubes, 2.0 ml with screw cap, nonsterile |
| SLS 96-deep Well plates | Greiner | 780285 | MASTERBLOCK, 2 ML, PP, V-Bottom, Natural |
| spin column | Millipore | UFC500396 | Amicon Ultra -0.5 ml Centrifugal Filters |
| Thermomixer | Eppendorf | 5382000015 | Thermomixer C |
| TLC plate (PEI-cellulose F TLC plates) | Merck Millipore | 105579 | DC PEI-cellulose F (20 x 20 cm) |
| Tris | SIGMA | BP152 | Tris Base for Molecular Biology |
| Tween 20 | SIGMA | P1379 | viscous non-ionic detergent |
| β-mercaptoethanol | SIGMA | M3148 | 99% (GC/titration) |
Referências
- Kalia, D., et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis. Chemical Society Reviews. 42 (1), 305-341 (2013).
- Camilli, A., Bassler, B. L. Bacterial small-molecule signaling pathways. Science. 311 (5764), 1113-1116 (2006).
- Luo, Y., et al. The cAMP capture compound mass spectrometry as a novel tool for targeting cAMP-binding proteins: from protein kinase A to potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channels. Molecular & Cellular Proteomics. 8 (12), 2843-2856 (2009).
- Nesper, J., Reinders, A., Glatter, T., Schmidt, A., Jenal, U. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. Journal of Proteomics. 75 (15), 4874-4878 (2012).
- Laventie, B. J., et al. Capture compound mass spectrometry–a powerful tool to identify novel c-di-GMP effector proteins. Journal of Visual Experiments. (97), e51404 (2015).
- Roelofs, K. G., Wang, J., Sintim, H. O., Lee, V. T. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proceedings of the National Academy of Sciences of the United States of America. 108 (37), 15528-15533 (2011).
- Zhang, Y., et al. Evolutionary adaptation of the essential tRNA methyltransferase TrmD to the signaling molecule 3 ‘,5 ‘-cAMP in bacteria. Journal of Biological Chemistry. 292 (1), 313-327 (2017).
- Corrigan, R. M., et al. Systematic identification of conserved bacterial c-di-AMP receptor proteins. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 9084-9089 (2013).
- Roelofs, K. G., et al. Systematic identification of cyclic-di-GMP binding proteins in Vibrio cholerae reveals a novel class of cyclic-di-GMP-binding ATPases associated with type II secretion systems. PLoS Pathogen. 11 (10), 1005232 (2015).
- Fang, X., et al. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria. Molecular Microbiology. 93 (3), 439-452 (2014).
- Corrigan, R. M., Bellows, L. E., Wood, A., Grundling, A. ppGpp negatively impacts ribosome assembly affecting growth and antimicrobial tolerance in Gram-positive bacteria. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 1710-1719 (2016).
- Zhang, Y., Zbornikova, E., Rejman, D., Gerdes, K. Novel (p)ppGpp binding and metabolizing proteins of Escherichia coli. Mbio. 9 (2), 02188 (2018).
- Yang, J., et al. The nucleotide pGpp acts as a third alarmone in Bacillus, with functions distinct from those of (p) ppGpp. Nature Communications. 11 (1), 5388 (2020).
- Orr, M. W., Lee, V. T. Differential radial capillary action of ligand assay (DRaCALA) for high-throughput detection of protein-metabolite interactions in bacteria. Methods in Molecular Biology. 1535, 25-41 (2017).
- Kitagawa, M., et al. Complete set of ORF clones of Escherichia coli ASKA library (A complete Set of E. coli K-12 ORF archive): Unique resources for biological research. DNA Research. 12 (5), 291-299 (2005).
- Hochstadt-Ozer, J., Cashel, M. The regulation of purine utilization in bacteria. V. Inhibition of purine phosphoribosyltransferase activities and purine uptake in isolated membrane vesicles by guanosine tetraphosphate. Journal of Biological Chemistry. 247 (21), 7067-7072 (1972).
- Zhang, Y. E., et al. p)ppGpp regulates a bacterial nucleosidase by an allosteric two-domain switch. Molecular Cell. 74 (6), 1239-1249 (2019).
- Wang, B., et al. Affinity-based capture and identification of protein effectors of the growth regulator ppGpp. Nature Chemical Biology. 15 (2), 141-150 (2019).

