Pseudomonas aeruginosa Enfeksiyon Modelinin Gerçek Zamanlı Değerlendirilmesi için Araçlar
Summary
Sentetik kistik fibrozis balgam ortamı (SCFM2), bakteriyel agregaları yüksek çözünürlükte gözlemlemek için hem konfokal lazer tarama mikroskopisi hem de floresan ile aktive hücre sıralama ile birlikte kullanılabilir. Bu makalede, antimikrobiyal tedavi sırasında toplam popülasyonları gelecekteki çalışmalar için bir platform olarak değerlendirme yöntemleri ayrıntılı olarak açıklar.
Abstract
Pseudomonas aeruginosa (Pa), kistik fibrozis (CF) ile ilişkili en yaygın fırsatçı patojenlerden biridir. Pa kolonizasyonu kurulduktan sonra, enfekte olan bakterilerin büyük bir kısmı hava yolu balgamının içinde biyofilmler oluşturur. CF balgamından izole edilen pa biyofilmlerinin, mekansal olarak organize edilmiş ve antimikrobiyal tolerans gibi klinik olarak ilgili fenotipler sergileyen ~10-1.000 hücrenin küçük, yoğun agregalarında büyüdüğü gösterilmiştir. Pa agregalarının değişen balgam ortamına nasıl tepki verdiğini incelemenin en büyük zorluklarından biri, agrega oluşumunu destekleyen besinsel olarak alakalı ve sağlam sistemlerin olmamasıdır. Sentetik bir CF balgam ortamı (SCFM2) kullanılarak, Pa agregalarının yaşam öyküsü konfokal lazer tarama mikroskopisi (CLSM) ve tek bir hücrenin çözünürlüğünde görüntü analizi kullanılarak gözlemlenebilir. Bu in vitro sistem, değişen büyüklükteki binlerce agreganın gerçek zamanlı, üç boyutlu ve mikron ölçeğinde gözlemlenmesine izin verir. Birey ve nüfus düzeylerinde, agregaları fenotip ve pozisyona göre gruplama yeteneğine sahip olmak, agregaların farklı gelişim aşamalarında gözlemlenmesine ve antibiyotik tedavisi gibi mikroçevrimdeki değişikliklere yanıtlarının hassasiyetle ayırt edilmesine kolaylaştırır.
Introduction
Pseudomonas aeruginosa (Pa), bağışıklık sistemi zayıf bireylerde kronik enfeksiyonlar oluşturan fırsatçı bir patojendir. Genetik hastalığı kistik fibrozis (CF) olanlar için, bu enfeksiyonlar ömür boyu sürebilir. CF, zaman içinde çeşitli mikrobiyal patojenler tarafından kolonize edilen hava yollarında viskoz, besin bakımından zengin bir balganın birikmesine neden olur. Pa, erken çocukluk döneminde hava yollarını kolonlaştıran ve tedavisi zor enfeksiyonlar kuran en yaygın CF patojenlerinden biridir1. Pa önemli bir klinik sorun olmaya devam ediyor ve son yıllarda iyileştirilmiş tedavi rejimlerine rağmen CF’lilerde önde gelen bir ölüm nedeni olarak kabul ediliyor2,3. Bu kalıcılık fenotipi ve artan antibiyotik toleransı, Pa’ya hem Hastalık Kontrol Merkezleri (CDC) hem de Dünya Sağlık Örgütü (WHO) tarafından yeni terapötik stratejilerin geliştirilmesi için araştırma öncelikleri olarak tanımlanan bir grup patojende yer kazandırdı-ESKAPE patojenleri4.
Diğer ESKAPE patojenleri gibi, edinilmiş antibiyotik direnci Pa‘da yaygındır, ancak Pa antimikrobiyal toleransa katkıda bulunan birçok içsel özellik de vardır. Bunlar arasında Pa’nın CF hasta balgam 5,6dahil olmak üzere birden fazla enfeksiyonda gözlemlenebilen ~ 10-1.000 hücreden oluşan agregalar-son derece yoğun kümeler oluşturma yeteneği vardır. Diğer biyofilm sistemlerinde çalışılan Pa’ya benzer şekilde, Pa agregaları antibiyotiklere karşı direncin artması ve hücre-hücre iletişiminin aktivasyonu (çekirdek algılama (QS)) gibi klinik olarak ilgili fenotipler gösterir. Örneğin, Pa agregalarının diğer mikroplarla mücadele etmek ve piocyanin üretimi gibi antimikrobiyal tedavileri tolere etmek için QS tarafından düzenlenmiş davranışları kullandığı gösterilmiştir7. Bu tür davranışları inceleme yeteneği, insan vücudunda var olduklarına benzer bir ortamda bakteri ekosistemleri hakkında heyecan verici bir içgörü sunar.
Pa agregalarının değişen balgam ortamına nasıl tepki verdiğini incelemenin en büyük zorluklarından biri, agrega oluşumunu destekleyen besinsel olarak alakalı ve sağlam sistemlerin olmamasıdır. Pa hakkında bilinenlerin çoğu, hücrelerin planktonik olarak büyüdüğü in vitro sistemler kullanılarak veya in vivo8’degözlemlenmeyen karakteristik bir yüzeye bağlı “mantar” mimarisi kullanılarak keşfedilmiştir. Akış hücreleri veya katı agar gibi klasik biyofilm büyüme modelleri bakteriyel davranışlar ve antibiyotik tolerans mekanizmaları hakkında kapsamlı ve değerli bilgiler vermiş olsa da, bu bulgular her zaman in vivo olarak çevrilmez. Birçok in vitro model, insan enfeksiyon bölgesinin büyüme ortamını taklit etme yeteneğine sahiptir ve pahalı in vivo çalışmalar gerektirir. Buna karşılık, birçok in vivo model in vitro tekniklerin sağladığı esneklik ve çözünürlükten yoksundur.
Sentetik kistik fibrozis balgam (SCFM2), CF akciğerinde kronik enfeksiyon sırasında yaşananlara benzer pa büyümesi için bir ortam sağlamak üzere tasarlanmıştır. SCFM2, müsin, lipitler ve DNA’ya ek olarak balgam sputasında tanımlanan besin kaynaklarını içerir. SCFM2’deki pa büyümesi, gerçek balgamda büyüme için gerekene ayarlanmış neredeyse aynı geni gerektirir ve doğal Pa agrega oluşumunudestekler 9,10. Aşılamadan sonra, planktonik hücreler genişleme yoluyla boyutu artan agregalar oluşturur. Tek tek hücreler (göçmenler olarak adlandırılır) agregalardan serbest bırakılır, kavunlanmamış alanlara geçirilir ve yeni agregalaroluşturur 10. Bu yaşam öyküsü, tek bir hücrenin çözünürlüğünde CLSM ve görüntü analizi kullanılarak gözlemlenebilir. SCFM2’de oluşan Pa agregaları CF akciğer10’dagözlenenlere benzer boyutlardadır. Bu model, mikron ölçeğinde gerçek zamanlı ve üç boyutta değişen boyutta birden fazla agreganın gözlemlenmesine izin verir. Zaman atlamalı mikroskopi, bir deneyde binlerce (~50.000) agreganın izlenmesini sağlar. Görüntü analizi yazılımının kullanımı, toplam hacim, yüzey alanı ve konum dahil olmak üzere mikrograflardan agrega fenotiplerinin hem bireysel toplam hem de popülasyon seviyelerinde en yakın 0,1 μm’ye kadar üç boyutta ölçülmesine olanak tanır. Agregaları fenotip ve konuma göre gruplandırma yeteneğine sahip olmak, farklı gelişim aşamalarındaki agregaların hassasiyetle farklılaştırılmasına ve değişen bir mikroçevreme6,11’eyanıt vermelerine izin verir.
SCFM2’nin Pa agregalarını düşük hacimli ve yüksek verimli testlerde incelemek için uygulanması, onu esnek, uygun maliyetli bir model haline getirir. Tanımlanmış bir ortam olarak SCFM2, birden fazla platformda homojenlik ve tekrarlanabilirlik sunarak Pa agregalarını in vitro9’daincelemek için besinsel ve fiziksel olarak alakalı bir yöntem sağlar. Uygulamalar, mekansal organizasyonu ve antibiyotik toleransını yüksek çözünürlükte gözlemlemek için CLSM ile birlikte kullanılmasını içerir (bu yöntem makalesinde açıklandığı gibi). Gerçek zamanlı, mikron ölçeğinde veriler sağlayan deneyler yapabilme yeteneği, tür içi ve türler arası etkileşimlerin vivo olarak ortaya çıkabileceği şekilde incelenmesineizin verir. Örneğin, SCFM2 daha önce virülans ve patogenez6’yakatkıda bulunan birden fazla geni düzenlemek için Pa tarafından kullanılan bir sistem ağı aracılığıyla hücre-hücre iletişiminin toplam popülasyonlardaki mekansal dinamiklerini incelemek için kullanılmıştır.
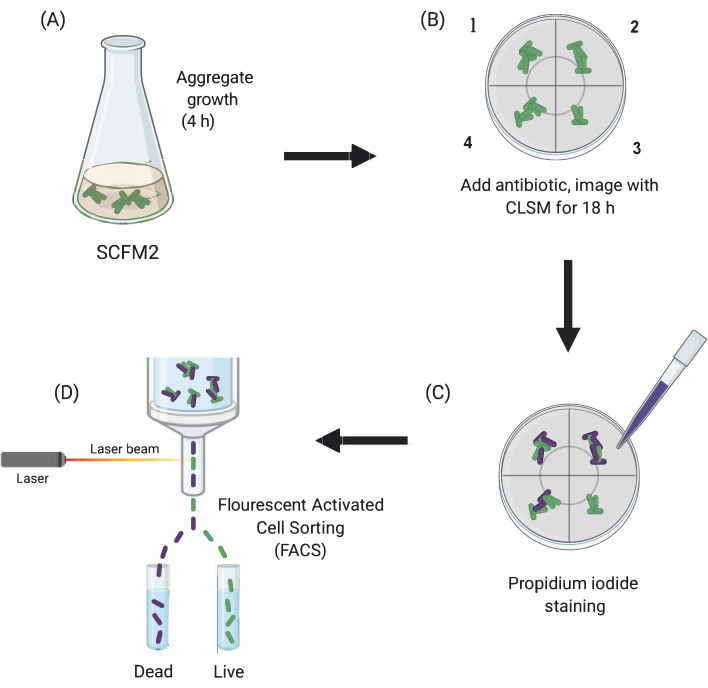
Şekil 1: Ana deneysel adımların grafiksel tasviri. (A) SCFM2 Pa hücreleri ile aşılanır ve cam tabanlı bir kültür çanağı içinde agrega oluşturmasına izin verilir. (B) Agregalar konfokal mikroskopa aktarılır ve antibiyotik eklenir. Antibiyotik tedavisi olmadan üç teknik kopya (oda 1-3) ve aşılanmış SCFM2 kontrol kuyusu (4) tasvir edilir. Toplamlar 18 saat boyunca CLSM kullanılarak görüntülenir. Kısaltmalar: SCFM2 = sentetik kistik fibrozis balgam ortamı; Pa = Pseudomonas aeruginosa; CLSM = konfokal lazer tarama mikroskopisi; FACS = floresanla etkinleştirilen hücre sıralama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Burada, SCFM2’nin antibiyotik tedavisinin Pa agregaları üzerindeki etkisini gerçek zamanlı olarak incelemek için faydası gösterilmiştir, ardından aşağı akış analizi için farklı fenotiplere sahip agrega popülasyonlarını izole etmek için bir hücre sıralama yaklaşımının kullanılması (Şekil 1).
Protocol
Representative Results
Discussion
Bu çalışma, antibiyotik tedavisinin varlığında ve yokluğunda bakteriyel agrega popülasyonlarını incelemek için birleştirilebilen metodolojileri getirmiştir. Yüksek çözünürlüklü CLSM, agrega biyokütleslerindeki değişikliklerin görselleştirilmesine ve antibiyotiklere maruz kaldığında agregaların gerçek zamanlı olarak yapısal yönelimine olanak tanır. Ek olarak, antibiyotiklerle tedaviden sonra kalan biyokütlenin fiziksel ve yapısal özellikleri, bu gözlemleri RNA-seq kullanarak gelecekte…
Declarações
The authors have nothing to disclose.
Acknowledgements
S.E.D, Güney Florida Üniversitesi Moleküler Tıp Bölümü tarafından sağlanan başlangıç fonlarının yanı sıra CFF araştırma hibesi (DARCH19G0) N.I.H (5R21AI147654 – 02 (PI, Chen)) ve USF Mikrobiyom enstitüsü tarafından desteklenmektedir. Whiteley laboratuvarına bu makaleyle ilgili veri setlerini içeren devam eden işbirliği için teşekkür ederiz. Dr. Charles Szekeres’e FACS sıralamasını kolaylaştıran için teşekkür ederiz. Rakamlar A.D.G ve S.E.D tarafından Biorender.com kullanılarak oluşturulmuştur.
Materials
| Amino acids | |||
| Alanine | Acr s Organics s Organics |
56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acr s Organics s Organics |
56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acr s Organics s Organics |
138-15-8 | |
| Glycine | Acr s Organics s Organics |
56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acr s Organics s Organics |
73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acr s Organics s Organics |
63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acr s Organics s Organics |
63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acr s Organics s Organics |
72-19-5 | |
| Tryptophan | Acr s Organics s Organics |
73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acr s Organics s Organics |
72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acr s Organics s Organics |
7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acr s Organics s Organics |
7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acr s Organics s Organics |
7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acr s Organics s Organics |
12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNAse/DNAse free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
Referências
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O’Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573 (2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913 (2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240 (2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).

