Análisis de seguimiento de nanopartículas para la cuantificación y determinación del tamaño de vesículas extracelulares
Summary
Demostramos cómo utilizar un nuevo instrumento de análisis de seguimiento de nanopartículas para estimar la distribución del tamaño y la concentración total de partículas de vesículas extracelulares aisladas de tejido adiposo perigonadal de ratón y plasma humano.
Abstract
Los roles fisiológicos y fisiopatológicos de las vesículas extracelulares (EV) se han vuelto cada vez más reconocidos, lo que hace que el campo EV sea un área de investigación en rápida evolución. Existen muchos métodos diferentes para el aislamiento de vehículos eléctricos, cada uno con ventajas y desventajas distintas que afectan el rendimiento y la pureza posteriores de los vehículos eléctricos. Por lo tanto, la caracterización de la preparación ev aislada de una fuente dada por un método elegido es importante para la interpretación de los resultados posteriores y la comparación de los resultados entre laboratorios. Existen varios métodos para determinar el tamaño y la cantidad de vehículos eléctricos, que pueden verse alterados por estados de enfermedad o en respuesta a afecciones externas. El análisis de seguimiento de nanopartículas (NTA) es una de las tecnologías prominentes utilizadas para el análisis de alto rendimiento de vehículos eléctricos individuales. Aquí, presentamos un protocolo detallado para la cuantificación y determinación del tamaño de los vehículos eléctricos aislados del tejido adiposo perigonadal de ratón y el plasma humano utilizando una tecnología innovadora para NTA que representa importantes avances en el campo. Los resultados demuestran que este método puede proporcionar datos reproducibles y válidos de concentración total de partículas y distribución de tamaño para vehículos eléctricos aislados de diferentes fuentes utilizando diferentes métodos, como lo confirma la microscopía electrónica de transmisión. La adaptación de este instrumento para NTA abordará la necesidad de estandarización en los métodos de NTA para aumentar el rigor y la reproducibilidad en la investigación de EV.
Introduction
Las vesículas extracelulares (VE) son pequeñas (0,03-2 μm) vesículas unidas a la membrana secretadas por casi todos los tipos de células1. A menudo se les conoce como “exosomas”, “microvesículas” o “cuerpos apoptóticos” dependiendo de su mecanismo de liberación y tamaño2. Si bien inicialmente se pensó que los VEHÍCULOS eléctricos eran simplemente un medio para eliminar los desechos de la célula para mantener la homeostasis3,ahora sabemos que también pueden participar en la comunicación intercelular a través de la transferencia de material molecular, incluido el ADN, el ARN (ARNm, microARN), los lípidos y las proteínas4,5, y que son importantes reguladores de la fisiología normal, así como de los procesos patológicos1, 5,6,7,8.
Hay muchos métodos diferentes para aislar y cuantificar los vehículos eléctricos, que se han descrito en otra parte9,10,11,12. El protocolo de aislamiento utilizado, así como la fuente de los vehículos eléctricos, pueden afectar en gran medida el rendimiento y la pureza de los vehículos eléctricos. Incluso la centrifugación diferencial, considerada durante mucho tiempo el enfoque “estándar de oro” para el aislamiento de exosomas, puede estar sujeta a una variabilidad sustancial que posteriormente afecta a la población de EV obtenida y a los análisis posteriores13. Por lo tanto, las diversas metodologías diferentes para el aislamiento y cuantificación de EV dificultan la comparación, reproducción e interpretación de los resultados de los experimentos reportados en la literatura14. Además, la liberación de EV puede ser regulada por condiciones celulares o varios factores externos. Se ha sugerido que los EV desempeñan un papel en el mantenimiento de la homeostasis celular al proteger a las células contra el estrés intracelular15,ya que varios estudios han demostrado que el estrés celular estimula la secreción de EV. Por ejemplo, se ha reportado un aumento de la liberación de EV después de la exposición celular a la hipoxia, el estrés del retículo endoplásmico, el estrés oxidativo, el estrés mecánico, el extracto de humo de cigarrillo y lacontaminacióndel aire por partículas16,17,18 , 19,20,21,22. También se ha demostrado que la liberación de EV se modifica in vivo; los ratones sometidos a una dieta alta en grasas o en ayunas durante dieciséis horas liberaron más vehículos eléctricos de adipocitos23. Para investigar si un tratamiento o afección específica altera la liberación de EV, el número de EV debe determinarse con precisión. La evaluación de la distribución del tamaño de ev también puede indicar el origen subcelular predominante de los EV (por ejemplo, fusión de endosomas tardíos/cuerpos multivesiculares con la membrana plasmática frente a la brotación de la membrana plasmática)24. Por lo tanto, existe la necesidad de métodos robustos para medir con precisión la concentración total y la distribución de tamaño de la preparación EV que se está estudiando.
Un método rápido y altamente sensible para la visualización y caracterización de vehículos eléctricos en solución es el análisis de seguimiento de nanopartículas (NTA). Una explicación detallada de los principios de este método y la comparación con métodos alternativos para la evaluación del tamaño y la concentración de EV se han descrito previamente25,26,27,28. Brevemente, durante la medición NTA, los vehículos eléctricos son visualizados por la luz dispersada cuando se irradian con un rayo láser. La luz dispersa es enfocada por un microscopio en una cámara que registra el movimiento de las partículas. El software NTA rastrea el movimiento térmico aleatorio de cada partícula, conocido como movimiento browniano, para determinar el coeficiente de difusión que se utiliza para calcular el tamaño de cada partícula utilizando la ecuación de Stokes-Einstein. NTA se aplicó por primera vez a la medición de vehículos eléctricos en una muestra biológica en 201125. Hasta hace poco, solo había dos compañías principales que ofrecían instrumentos NTA comerciales29 hasta la introducción del ViewSizer 3000 (en adelante, el instrumento de seguimiento de partículas) que utiliza una combinación de nuevas soluciones de hardware y software para superar las limitaciones significativas de otras técnicas NTA.
El instrumento de seguimiento de partículas caracteriza las nanopartículas en muestras líquidas mediante el análisis de su movimiento browniano y caracteriza partículas más grandes del tamaño de micras mediante el análisis de la sedimentación gravitacional. El sistema óptico único de este instrumento, que incluye iluminación multiespectral con tres fuentes de luz láser (a 450 nm, 520 nm y 635 nm), permite a los investigadores analizar una amplia gama de tamaños de partículas (por ejemplo, exosomas, microvesículas) simultáneamente. En la Figura 1se muestra un esquema de la configuración del instrumento.
Aquí, demostramos cómo realizar mediciones de distribución y concentración del tamaño de partícula de vehículos eléctricos aislados de ratones y humanos utilizando un nuevo instrumento NTA.
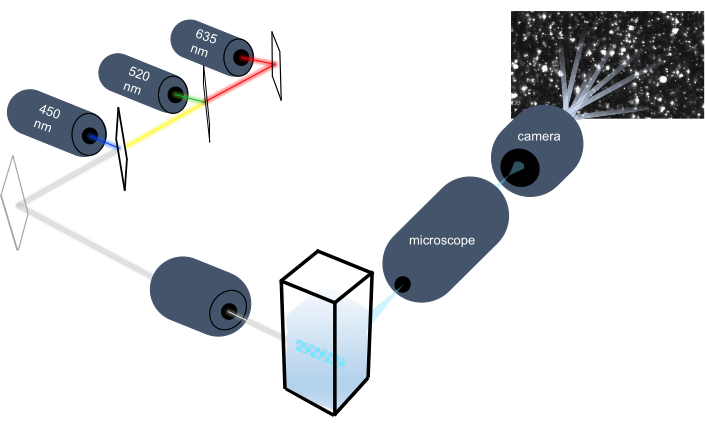
Figura 1: Sistema óptico del instrumento de seguimiento de partículas. El instrumento NTA ilumina partículas utilizando tres láseres con las siguientes longitudes de onda: 450 nm, 520 nm, 635 nm. La grabación de video de la luz dispersa de partículas individuales es detectada y rastreada por una cámara de video digital orientada a 90 ° desde la cubeta. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Aquí, demostramos un protocolo para NTA de EV para medir la distribución de tamaño de una amplia gama de tamaños de partículas simultáneamente y medir la concentración total de EV en una muestra polidispersa. En este estudio, se utilizó tejido adiposo perigonadal de ratón y plasma humano como fuente de vehículos eléctricos. Sin embargo, los VEHÍCULOS eléctricos aislados de otros tejidos o fluidos biológicos como suero, orina, saliva, leche materna, líquido amniótico y sobrenadante de cultivo celular tambi…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por los Institutos Nacionales de Salud (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Reconocemos a Jeffrey Bodycomb, Ph.D. de HORIBA Instruments Incorporated por su ayuda en la calibración del instrumento.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Referências
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

