Positron Emission Tomography-basert dosemalingsstrålebehandling i en Glioblastoma Rat-modell ved hjelp av Small Animal Radiation Research Platform
Summary
Her presenterer vi en protokoll for å utføre preklinisk positronutslippstolografibasert strålebehandling i en rotte glioblastommodell ved hjelp av algoritmer utviklet internt for å optimalisere nøyaktigheten og effektiviteten.
Abstract
En rotte glioblastom modell for å etterligne kjemo-stråling behandling av menneskelig glioblastom i klinikken ble tidligere etablert. I likhet med den kliniske behandlingen ble beregnet tomografi (CT) og magnetisk resonansavbildning (MR) kombinert under behandlingsplanleggingsprosessen. Positron utslipp tomografi (PET) avbildning ble senere lagt til for å implementere sub-volum boosting ved hjelp av et mikro-bestråling system. Men å kombinere tre avbildningsmodaliteter (CT, MR og PET) ved hjelp av et mikrobestrålingssystem viste seg å være arbeidskrevende fordi multimodal avbildning, behandlingsplanlegging og doselevering må fullføres sekvensielt i den prekliniske innstillingen. Dette resulterer også i en arbeidsflyt som er mer utsatt for menneskelig feil. Derfor ble det implementert en brukervennlig algoritme for å optimalisere preklinisk multimodal bildebehandlingsbasert strålebehandlingsplanlegging ytterligere. Dette programvareverktøyet ble brukt til å evaluere nøyaktigheten og effektiviteten av dosemalingsstrålebehandling med mikrobestråling ved hjelp av en i silico studiedesign. Den nye metodikken for dosemalingsstrålebehandling er bedre enn den tidligere beskrevne metoden når det gjelder nøyaktighet, tidseffektivitet og intra- og brukervariabilitet. Det er også et viktig skritt mot implementering av omvendt behandlingsplanlegging på mikro-bestrålere, hvor planlegging fremover fortsatt er vanlig brukt, i motsetning til kliniske systemer.
Introduction
Glioblastom (GB) er en ondartet og svært aggressiv primær hjernesvulst. GB er en solid heterogen svulst som vanligvis er preget av infiltratære grenser, kjernefysisk atypia og nekrose1. Tilstedeværelsen av blod-hjerne-barrieren og hjernens status som et immunprivilegert sted gjør oppdagelsen av nye mål for kjemo- og immunterapi til en skremmende oppgave2,3,4. Det er bemerkelsesverdig at behandlingen av GB-pasienter knapt har endret seg siden introduksjonen, i 2005, av Stupp-protokollen som kombinerer ekstern strålestrålebehandling (RT) med samtidig temozolomid, vanligvis etterfulgt av adjuvant temozolomide5. Vanligvis er Stupp-protokollen innledet med maksimal kirurgisk reseksjon. Derfor er alternative behandlingsmetoder av avgjørende betydning.
Gjeldende strålebehandling for glioblastompasienter gir en jevn strålingsdose til det definerte tumorvolumet. I stråling onkologi er det en viktig dose-respons korrelasjon for glioblastom med økende dose, som synes å cap rundt 60 Gy, på grunn av økt toksisitet til den normale hjernen6,7. Svulster kan imidlertid være svært (radiobiologisk) heterogene, med gradienter av oksygennivå og / eller store forskjeller i cellulær tetthet. Metabolske avbildningsteknikker, som PET, kan visualisere disse biologiske egenskapene og kan brukes til å tilpasse doseresepten. Denne tilnærmingen er kjent som dosemaling RT. Dette begrepet ble introdusert av Ling et al. i 2000. Forfatterne definerte dosemaling RT som å produsere “utsøkt konforme dosefordelinger innenfor begrensningene av strålingsforplantning og spredning”8.
Det er to typer dosemaling RT, dosemaling etter konturer (DPBC), hvorved en dose er foreskrevet til et sett med nestede undervolumer, og dosemaling etter tall (DPBN), hvorved en dose foreskrives på voxelnivå. Dosefordelingen for DPBN RT kan trekkes ut fra funksjonelle bilder. Dosen i hver voxel bestemmes av intensiteten I av den tilsvarende voxelen i bildet, med en nedre og øvre grense, for å sikre at en tilstrekkelig dose på den ene siden leveres til hver del av svulsten. På den annen side overstiger doser ikke en øvre grense for å beskytte organer i fare og unngå toksisitet. Den enkleste metoden er en lineær interpolering (se Eq. 1) mellom minimumsdose Dmin og maksimal dose Dmax, proporsjonalt varierende mellom minimum intensitet Imax og maksimal intensitet innenfor målvolumet9,10
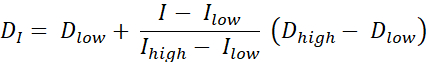 Eq. 1
Eq. 1
Fordi det er en viss skepsis til kvalitetssikringen av DPBN RT, bør avsetningen av dosen verifiseres gjennom preklinisk og klinisk forskning10. Imidlertid kan bare begrensede data innhentes fra kliniske studier, og det har blitt hypoteset at mer innsikt kan oppnås ved nedskalering til laboratoriedyr11,12. Derfor er prekliniske studier som bruker presisjonsbildestyrte strålingsforskningsplattformer som tillater kobling med noen svært spesifikke teknikker, for eksempel autoradiografi, egnet for å undersøke åpne problemer og bane vei mot personlig medisin og nye behandlingsstrategier, for eksempel dosemaling RT13,14. Tolkningen av prekliniske data må imidlertid utføres med forsiktighet, og ulemper ved disse prekliniske oppsettene må vurderes som14.
Mikrobestrålingssystemer, som Small Animal Radiation Research Platform (SARRP), er utstyrt med lignende teknologier som deres kliniske motpart. De inkluderer innebygd kjeglestråle CT (CBCT) avbildning, et preklinisk behandlingsplanleggingssystem (PCTPS), og gir under millimeter presisjon. Kliniske doseberegninger utføres ved omvendt behandlingsplanlegging, hvorved man initierer fra ønsket dosefordeling for å bestemme bjelkene via en iterativ algoritme. Prekliniske bestrålere bruker ofte planlegging fremover. I planlegging fremover velges den nødvendige mengden og vinkelen på bjelkene, og PCTPS beregner deretter dosefordelingen. Optimaliseringen av planene utføres ved manuell gjentakelse, som er arbeidsintensiv15.
Etter 2009 har en ny utvikling gjort gjennomføringen av omvendt planlegging på disse forskningsplattformene mulig16,17,18. For å øke likheten med den kliniske metoden ble en motorisert variabel rektangulær collimator (MVC) utviklet som en preklinisk motstykke til multibladkollimatøren. En todimensjonal dosemalingsmetode ved hjelp av en variabel kolimatør ble publisert av Cho et al.19. Denne forskningsgruppen implementerte en tredimensjonal (3D) omvendt behandlingsplanleggingsprotokoll på en mikro-bestråler og bestemte minimums- og maksimumsdoser for målvolumet og en maksimal dose for organene i fare. Disse teknikkene har hovedsakelig blitt evaluert i silico, og deres prekliniske applikasjoner må utforskes.
Denne artikkelen presenterer en i silicostudie for å sammenligne to metoder for [18F]-fluor-etyl-L-tyrosin ([18F]FET) PET-basert dosemaleri i en GB rottemodell20,21,22 ved hjelp av en liten forskningsplattform for dyrestråling. Disse to metodene er (1) undervolumforsterking ved hjelp av forhåndsdefinerte strålestørrelser og (2) dosemaling ved hjelp av en motorisert variabel collimator der kjevedimensjoner endres basert på PET-traceropptaket i tumorvolumet. [18F] FET er en PET-tracer som ofte brukes i nevro-onkologi på grunn av sin evne til å oppdage hjernesvulster23. [18F] FET er en kunstig aminosyre som internaliseres i tumorceller, men ikke innlemmet i celleproteiner. [18F] FET-opptak tilsvarer celleproliferasjonshastighet, tumorcelletetthet og angiogenese24. Siden dette er den mest brukte onkologiske hjernen PET tracer i disse forfatternes institutt, ble denne radiotraceren valgt for å evaluere den nye arbeidsflyten.
Protocol
Representative Results
Discussion
En rotte GB modell for å etterligne kjemo-stråling behandling i klinikken for glioblastom pasienter ble tidligere beskrevet20. I likhet med den kliniske metoden ble CT og MR kombinert under behandlingsplanleggingsprosessen for å oppnå mer presis bestråling. En multimodalitetsseng for å minimere (hode) bevegelse ble brukt da dyret ble flyttet fra ett bildesystem til et annet. Deretter ble PET-avbildning lagt til behandlingsprosessen, og PET-basert undervolumøkning kunne implementeres <sup cl…
Declarações
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil takke Lux Luka Foundation for å støtte dette arbeidet.
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
Referências
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

