Summary
מוצג כאן פרוטוקול ליצירת רקמות חיבור מהונדסות לתרבות מקבילה של 48 רקמות בלוח רב-בארות עם מוטות כפולים, המתאימים למחקרים מכאניסטיים, מידול מחלות ויישומי סינון. הפרוטוקול תואם פיברובלסטים מאיברים ומינים שונים ומודגם כאן עם פיברובלסטים לב ראשוניים אנושיים.
Abstract
פיברובלסטים הם תאים דינמיים מאוד פנוטיפיים, אשר במהירות transdifferentiate לתוך myofibroblasts בתגובה גירויים ביוכימיים וביומכניים. ההבנה הנוכחית של תהליכים פיברוטיים, כולל פיברוזיס לב, נותרה גרועה, מה שמעכב את התפתחותם של טיפולים אנטי-פיברוטיים חדשים. מערכות מודל אנושיות ניתנות לשליטה ואמינות חיוניות להבנה טובה יותר של פתולוגיה פיברוזיס. זהו פרוטוקול רב-רב-ממד ליצירת רקמות חיבור מהונדסות (ECT) בלוח יציקה של 48 בארות כדי להקל על מחקרים על פיברובלסטים ועל הפתופיזיולוגיה של רקמה פיברוטית בסביבה תלת-ממדית (תלת-ממדית). ECT נוצרים סביב הקטבים עם נוקשות טונה, המאפשר מחקרים תחת עומס ביומכני מוגדר. תחת תנאי הטעינה המוגדרים, ניתן ללמוד התאמות פנוטיפיות הנשלטות על ידי אינטראקציות מטריצת תאים. בדיקה מקבילה אפשרית בפורמט 48-well עם הזדמנות לניתוח מסלול זמן של פרמטרים מרובים, כגון דחיסת רקמות והתכווצות נגד העומס. מפרמטרים אלה, תכונות ביומכניות כגון נוקשות רקמות וגמישות ניתן ללמוד.
Introduction
מכשול מרכזי בחקר מחלות פיברוטיות הוא היעדר מודלים ייצוגיים של רקמת תלת-ממד אנושית המספקים תובנה על התנהגותם של פיברובלסטים ונגזרותיהם הפתולוגיות. כדי לחקור תהליכים פיברוטיים, מערכות תרבות 2D סטנדרטיות הן תת-אופטימליות מאז פיברובלסטים מבודדים transdifferentiate במהירות לתוך אקטין שריר חלק α (SMA) – ביטוי myofibroblasts כאשר מתורבת על מצעים 2D שאינם תואמים1,2,3. לכן, פיברובלסטים בתרבות הדו-ממדית הסטנדרטית אינם משקפים פנוטיפ רגיל של רקמות “בריאות”3,4,5,6. תרבויות על מצעים גמישים הוצגו כדי לדמות סביבות רקמות לא סיביות (10 kPa) ופיברוטיות (35 kPa)7, אך אלה חסרות את הממד השלישי, וזה חשוב מאוד ביחס לפתופיזיולוגיה. הנדסת רקמות מספקת את ההזדמנות להתגבר על מגבלה זו על ידי מתן אפשרות לתרבות פיברובלסט בהקשר של מטריצה חוץ-תאית מוגדרת וניסוי טונה (ECM), למשל, על ידי שינויים בתאיות, הרכב ECM וריכוז ECM, שכולם יכולים לקבוע את הביומכניקה של הרקמה.
דגמי תלת-ממד שונים נוצרו באמצעות פיברובלסטים. דיסקים ומיקרוספרות צפים היו בין הראשונים והוכיחו כי קולגן שופץ ונדחס באופן תלוי זמן. פיברובלסטים מפעילים כוחות אחיזה על סיבי קולגן, תהליך אשר ניתן להקל על ידי תוספת של סוכנים פרו-פיברוטיים כגון שינוי גורם גדילה-בטא 1 (TGF-β1)8,9,10,11,12,13,14,15,16. עם זאת, תרבויות צפות בחופשיות אינן מאפשרות טעינה חיצונית מבוקרת, ולכן מהוות דגמים מתכווצים או דוחסים ללא הרף. רקמות מהונדסות דמויות גיליון פתחו את האפשרות לחקור רגולציה הומאוסטטית של תכונות ביומכניות של רקמות, כלומר באמצעות בדיקות זנים חד, דו-מיניות, רב-זמניות או מחזוריות17,18,19,20. מודלים אלה שימשו, למשל, כדי להדגים את ההשפעה של מספר התא על נוקשות הרקמה, אשר נמצאה בקורלציה חיובית עם שלמות cytoskeleton ו צמצום ציטוסקילטון18,19. עם זאת, חשוב לציין כי המרות כוח למתח מסובכות על ידי עיוות רקמות לא אחיד סביב נקודות מהדק של מתמרים כוח ונקודות עיגון. מגבלה אינהרנטית זו יכולה לעקוף על ידי עצם כלב או רקמות בצורת טבעת, המציעות אכיפת רקמות מסוימת בנקודות עיגון21,22,23. ניתן להכין רקמות בצורת טבעת על ידי הפצת הידרוג’ל קולגן לתא לתבניות בצורת טבעת. כמו הידרוג’ל קומפקטי, רקמה נוצרת סביב המוט הפנימי הבלתי ניתן לריסון של התבנית, אשר מציע עמידות עבור התכווצות רקמות נוספת24,25,26,27. לאחר דחיסה ראשונית ובדרך כלל מקסימלית, רקמות עשויות להיות מועברות גם למרווחים מתכווננים כדי לרסן עוד יותר את ה- ECT המעגלי באורך רקמות מוגדר3,24,25,26,27,28,29,30. תכונות ביופיסיות ניתן להעריך התקנים סטנדרטיים אופקי או אנכי מתח מתח עם תאי עומס מתאימים תחת זן חד כיווני או דינמי3. מכיוון שלרקמות מבנה מעגלי אחיד ברובו וניתן להחזיק אותן על סורגים/ווים (נקודות עיגון ו/או מתמרי כוח), אם כי אלה עשויים עדיין לתחום אזורי דחיסה סביב מוטות הטעינה, פורמט זה מאפשר וריאציית מאמץ אחידה יותר בהשוואה להדק3. יתר על כן, רקמות מעוגנות מעוררות צורת תא דו קוטבי, ותאים מסתגלים לכוחות הרקמה על ידי התארכות לאורך קווי כוח המקדמים אחיזה אניזוטרופית31,32,33,34,35,36. יש לנו בעבר מיושם ECT בצורת טבעת מן חולדה ופיברובלסטים לב אנושיים (CF) סביב מוט נוקשה אחד בניסויים פונקציונליים מתח-זן וביצע רווח ואובדן של מחקרי פונקציה באמצעות פיברובלסטים transduced ויראלי24,25,26 ולימודים פרמקולוגיים37. יתר על כן, אנו יכולים לזהות הבדלי מין בפיברוזיס בתיווך CF במודל ECT27.
הפרוטוקול הבא ליצירת ECT אנושי, המודגם עם CF אנושי ראשוני המתקבל כ- CF cryopreserved מספקים מסחריים (ראה טבלה של חומרים), משלב את היתרונות של רקמות בצורת טבעת עם דרך קלה ומהירה לייצר רקמות מקרוסקופיות עבור פלטפורמה של 48 באר המיועדת לבדיקות מקבילות בעלות תוכן גבוה.
חשוב לציין, מודל ECT אינו מוגבל לסוג פיברובלסט מסוים, עם השימוש המתועד בחקירה של פיברובלסטים אחרים, למשל, פיברובלסטים בעור38,39. יתר על כן, פיברובלסטים מהביופסיות של המטופל פועלים באותה מידה, ובחירת הפיברובלסטים תלויה בסופו של דבר בשאלה המדעית שיש לטפל בה.
הפלטפורמה המשמשת לדור של ECT המתואר בפרוטוקול זה היא לוח תרבית תא/רקמה 48-well זמין מסחרית (איור 1A). השיטות להכנה, culturing, וניטור היווצרות ECT ותפקוד תחת גיאומטריה מוגדרת ועומס מכני בעזרת צלחת 48-well מתוארים. ECT שנוצר מוחזקים על ידי מוטות גמישים משולבים ואת העומס המכני ניתן לכוונן על פי המטרה הסופית באמצעות מוטות עם קשיות שונה (ערך חוף 36-89), המשפיעים על נוקשות הכיפוף שלהם. פולנים עם חוף ערך של 46 מומלצים. הפרוטוקול, בנוסף, תואם עובש עגול מותאם אישית שתואר בעבר, שבו ECT מוחזק סביב מוט נוקשה אחד37. הממדים של עובש זה ניתנים באיור 1B.
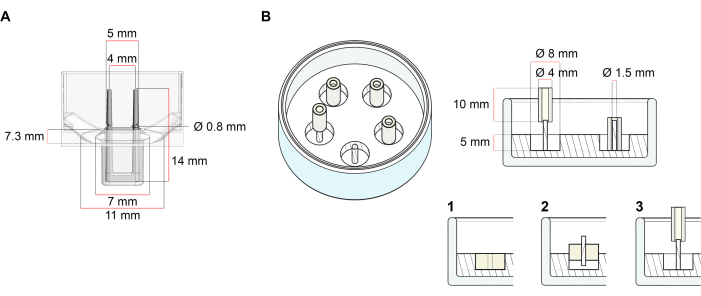
איור 1: ייצוג סכמטי של תבניות יציקה. (א) שרטוט טכני ומידות של תבנית יציקה עם שני קטבים גמישים. התבנית כוללת היקף פנימי המופרד על ידי קיר קצר המכיל מוטות תמך כפולים בגוף הראשי של התבנית. לקטבים הגמישים יש מרחק אופקי חופשי זה לזה והם מחוברים בבסיס. התבנית מאפשרת נפח יציקה של 180 μL. הבאר של כל עובש מאפשרת קיבולת נפח של לפחות 600 μL של מדיה תרבותית. קומפוזיציות חומר שונות ניתן להשתמש כדי לייצר קטבים עם נוקשות ספציפית (למשל, TM5MED-TM9MED). (ב) שרטוט טכני ומידות של תבנית בצורת טבעת עם מוט נוקשה יחיד. זוהי תבנית חלופית עם גיאומטריה ברורה וסביבה מכנית, אשר ניתן להשתמש עם פרוטוקול יציקת ECT37. שיטת הרכבת העובש בצורת טבעת הותאמה מתבניות גדולות יותר שפורסמו28,41. בקצרה, השיטה כוללת (1) חותם פוליטרפלואורואתילן (PTFE) דפוס מרווחים (קוטר 8 מ”מ) בפולידימתילסילוקסן (PDMS, סיליקון) שפכו לתוך כלים זכוכית (קוטר 60 מ”מ), ו (2) תיקון מחזיק מוט PDMS (קוטר 1.5 מ”מ) קונצנטרי בתוך החלל החלול שנוצר, אשר משמש (3) להחזיק מוט נשלף (צינור סיליקון קוטר 4 מ”מ). תוצאת החלל החלולה מאפשרת 180 μL של נפח הליהוק. כל צלחת זכוכית יכולה להכיל תבניות מוטבעות מרובות (מוצגות בצורה מופת עם 5 תבניות) ויש לה את היכולת של עד 5 מ”ל של מדיום תרבות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
הפרוטוקול המוצג מתאר את הדור של ECT מ- CF האנושי העיקרי, המאפשר לחקור את ההשפעה המכנית של תאים אלה על סביבת המטריצה החוץ-תאית שלהם ולהיפך.
הפיברובלסטים צריכים להיות מורחבים כדי להניב תאים מספיקים לניסויי ECT המתוכננים (0.75 x 106 תאים / ECT). עבור הרבייה הטובה ביותר, מומלץ מראש תר?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי אגודת הלב הגרמנית (מלגת המחקר DGK ל- GLS) ועל ידי קרן המחקר הגרמנית (DFG באמצעות פרויקט IRTG 1816 עבור GLS ו- AD; DFG 417880571 ו DFG TI 956/1-1 עבור MT; SFB 1002 TP C04 עבור הר ו- WHZ; SFB 1002 TP S01 עבור WHZ; ו EXC 2067/1-390729940J עבור WHZ). WHZ נתמך על ידי המשרד הפדרלי הגרמני למדע וחינוך (BMBF באמצעות הפרויקט IndiHEART), ואת פונדציה Leducq (20CVD04). MT, WHZ ו- SL נתמכים על ידי המרכז הגרמני לחקר הלב וכלי הדם (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

