Tessuto connettivo ingegnerizzato umano derivato da fibroblasti per applicazioni di screening
Summary
Qui viene presentato un protocollo per generare tessuti connettivi ingegnerizzati per una coltura parallela di 48 tessuti in una piastra multi-pozzo con doppi poli, adatto per studi meccanicistici, modellazione di malattie e applicazioni di screening. Il protocollo è compatibile con fibroblasti di diversi organi e specie ed è esemplificato qui con fibroblasti cardiaci primari umani.
Abstract
I fibroblasti sono cellule fenotipicamente altamente dinamiche, che si trasdifferentizzano rapidamente in miofibroblasti in risposta a stimoli biochimici e biomeccanici. L’attuale comprensione dei processi fibrotici, compresa la fibrosi cardiaca, rimane scarsa, il che ostacola lo sviluppo di nuove terapie anti-fibrotiche. Sistemi modello umano controllabili e affidabili sono fondamentali per una migliore comprensione della patologia fibrosa. Si tratta di un protocollo altamente riproducibile e scalabile per generare tessuti connettivi ingegnerizzati (ECT) in una piastra di colata a 48 pozzetti per facilitare gli studi sui fibroblasti e la fisiopatologia del tessuto fibrotico in un ambiente tridimensionale (3D). Gli ECT sono generati attorno ai poli con rigidità sintonizzabile, consentendo studi sotto un carico biomeccanico definito. Nelle condizioni di carico definite, possono essere studiati adattamenti fenotipici controllati dalle interazioni cellula-matrice. Il test parallelo è fattibile nel formato a 48 pozzetti con l’opportunità per l’analisi del percorso temporale di più parametri, come la compattazione e la contrazione dei tessuti contro il carico. Da questi parametri è possibile studiare le proprietà biomeccaniche come la rigidità e l’elasticità dei tessuti.
Introduction
Uno dei principali ostacoli nello studio delle malattie fibrotiche è la mancanza di modelli di tessuto 3D umano rappresentativi che forniscano informazioni sul comportamento dei fibroblasti e dei loro derivati patologici. Per studiare i processi fibrotici, i sistemi di coltura 2D standard sono sub-ottimali poiché i fibroblasti isolati si transdifferenziano rapidamente in miofibroblasti che esprimono α-liscia di actina muscolare (SMA) quando coltivati su substrati 2D non conformi1,2,3. Pertanto, i fibroblasti nella coltura 2D standard non riflettono un fenotipo tissutale “sano” regolare3,4,5,6. Sono state introdotte colture su substrati flessibili per simulare ambienti tissutali non fibrotici (10 kPa) e fibrotici (35 kPa)7, ma questi mancano della terza dimensione, che è molto importante per quanto riguarda la fisiopatologia. L’ingegneria tissutale offre l’opportunità di superare questa limitazione consentendo la coltura di fibroblasti in un contesto di matrice extracellulare (ECM) definito e sperimentalmente sintonizzabile, ad esempio mediante alterazioni della cellularità, della composizione ECM e della concentrazione di ECM, che possono determinare la biomeccanica tissutale.
Vari modelli 3D sono stati generati utilizzando fibroblasti. I dischi galleggianti e le microsfere sono stati tra i primi e dimostrano che il collagene viene rimodellato e compattato in modo dipendente dal tempo. I fibroblasti esercitano forze di trazione sulle fibrille di collagene, un processo che può essere facilitato dall’aggiunta di agenti pro-fibrotici come il fattore di crescita trasformante-beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Tuttavia, le colture liberamente fluttuanti non consentono il carico esterno controllato e, pertanto, costituiscono modelli in continua contrazione o compattazione. I tessuti ingegnerizzati simili a fogli hanno aperto la possibilità di studiare la regolazione omeostatica delle proprietà biomeccaniche dei tessuti, in particolare attraverso test di deformazione uni, bi, multiassiale o ciclica17,18,19,20. Questi modelli sono stati utilizzati, ad esempio, per dimostrare l’influenza del numero di cellule sulla rigidità del tessuto, che è risultata correlata positivamente con l’integrità del citoscheletro e la contrattilità del citoscheletro dell’actomiosina.18,19. Tuttavia, è importante notare che le conversioni forza-deformazione sono complicate dalla deformazione tissutale non uniforme attorno ai punti di serraggio dei trasduttori di forza e dei punti di ancoraggio. Questa limitazione intrinseca può essere aggirata da ossa di cane o tessuti a forma di anello, offrendo una certa applicazione dei tessuti nei punti di ancoraggio21,22,23. I tessuti a forma di anello possono essere preparati distribuendo un idrogel di collagene cellulare in stampi a forma di anello. Mentre l’idrogel si compatta, un tessuto si forma attorno all’asta interna incomprimibile dello stampo, che offre resistenza per un’ulteriore contrazione del tessuto24,25,26,27. Dopo la compattazione iniziale e tipicamente massima, i tessuti possono anche essere trasferiti a distanziali regolabili per trattenere ulteriormente l’ECT circolare a una lunghezza di tessuto definita.3,24,25,26,27,28,29,30. Le proprietà biofisiche possono essere valutate in dispositivi standard orizzontali o verticali di deformazione-sollecitazione con celle di carico appropriate sotto deformazione unidirezionale o dinamica3. Poiché i tessuti hanno una struttura circolare ampiamente uniforme e possono essere tenuti su barre/ganci (punti di ancoraggio e/o trasduttori di forza), sebbene questi possano ancora racchiudere aree di compressione attorno alle barre di carico, questo formato consente una variazione di deformazione più uniforme rispetto al serraggio3. Inoltre, i tessuti ancorati suscitano una forma cellulare bipolare e le cellule si adattano alle forze tissutali per allungamento lungo le linee di forza promuovendo la trazione anisotropica.31,32,33,34,35,36. In precedenza abbiamo applicato ECT a forma di anello da fibroblasti cardiaci (CF) di ratto e umani attorno a un singolo polo rigido in esperimenti di stress funzionale e abbiamo eseguito studi di guadagno e perdita di funzione utilizzando fibroblasti trasdotti viralmente24,25,26 e studi farmacologici37. Inoltre, potremmo identificare le differenze sessuali nella fibrosi cf-mediata nel modello ECT27.
Il seguente protocollo per la generazione di ECT umano, esemplificato con CF umano primario ottenuto come CF crioconservato da fornitori commerciali (vedi Tabella dei materiali), combina i vantaggi dei tessuti a forma di anello con un modo semplice e veloce di produrre tessuti macroscopici per una piattaforma a 48 pozzi progettata per test paralleli ad alto contenuto.
È importante sottolineare che il modello ECT non è limitato a un tipo specifico di fibroblasti, con l’uso documentato nello studio di altri fibroblasti, ad esempio fibroblasti cutanei38,39. Inoltre, i fibroblasti delle biopsie del paziente funzionano altrettanto bene e la scelta dei fibroblasti dipende in ultima analisi dalla questione scientifica da affrontare.
La piattaforma utilizzata per la generazione di ECT descritta in questo protocollo è una piastra di coltura cellulare/tissutale 3D a 48 pozzetti disponibile in commercio (Figura 1A). Vengono descritti i metodi per la preparazione, la coltivazione e il monitoraggio della formazione e della funzione dell’ECT sotto una geometria definita e un carico meccanico con l’aiuto della piastra a 48 pozzetti. Gli ECT formati sono tenuti da pali flessibili integrati e il carico meccanico può essere messo a punto in base allo scopo finale utilizzando pali con diversa durezza (shore A valore 36-89), influenzandone le rigidità di flessione. Si raccomandano pali con una riva Un valore di 46. Il protocollo è, inoltre, compatibile con uno stampo circolare personalizzato precedentemente descritto, in cui l’ECT è tenuto attorno a una singola asta rigida37. Le dimensioni di questo stampo sono indicate nella Figura 1B.
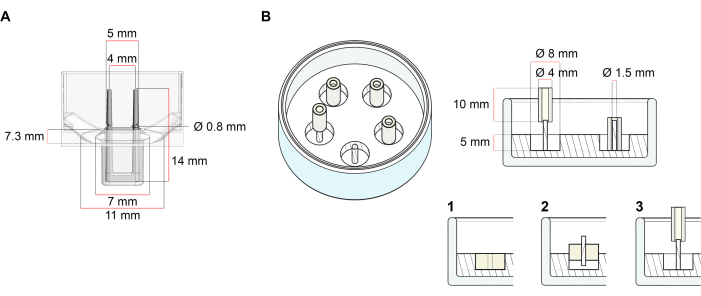
Figura 1: Rappresentazione schematica degli stampi di fusione. (A) Disegno tecnico e dimensioni di uno stampo di colata con due poli flessibili. Lo stampo comprende una circonferenza interna delimitata da una parete corta che contiene doppi pali di ritenzione sul corpo principale dello stampo. I poli flessibili hanno una distanza orizzontale libera l’uno dall’altro e sono collegati alla base. Lo stampo consente un volume di fusione di 180 μL. Il pozzetto di ogni stampo consente una capacità volumetrica di almeno 600 μL di terreno di coltura. Diverse composizioni di materiali possono essere utilizzate per produrre pali con rigidità specifiche (ad esempio, TM5MED-TM9MED). (B) Disegno tecnico e dimensioni di uno stampo a forma di anello con una singola asta rigida. Si tratta di uno stampo alternativo con geometria e ambiente meccanico distinti, che può essere utilizzato con il protocollo di fusione ECT37. Il metodo di assemblaggio dello stampo a forma di anello è stato adattato dai formati più grandi pubblicati28,41. In breve, il metodo include (1) l’imprinting di distanziali di stampaggio in politetrafluoroetilene (PTFE) (diametro 8 mm) in polidimetilsilossano (PDMS, silicone) versato in piatti di vetro (diametro 60 mm) e (2) il fissaggio di un supporto per palo PDMS (diametro 1,5 mm) concentricamente all’interno della cavità cava formata, che serve a (3) tenere un palo rimovibile (tubo in silicone di 4 mm di diametro). Lo spazio vuoto risultante consente 180 μL di volume di colata. Ogni piatto di vetro può contenere più stampi impressi (mostrati in modo esemplare con 5 stampi) e ha la capacità di raggiungere fino a 5 ml di terreno di coltura. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo presentato descrive la generazione di ECT da CF umano primario, che consente di studiare l’impatto meccanico di queste cellule sul loro ambiente di matrice extracellulare e viceversa.
I fibroblasti devono essere espansi per produrre cellule sufficienti per gli esperimenti ECT pianificati (0,75 x 106 cellule / ECT). Per la migliore riproducibilità, si consiglia di pre-coltivare fibroblasti congelati o derivati da tessuti in coltura monostrato 2D per una durata standard…
Declarações
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto dalla German Cardiac Society (DGK Research Fellowship for GLS) e dalla German Research Foundation (DFG attraverso il progetto IRTG 1816 per GLS e AD; DFG 417880571 e DFG TI 956/1-1 per MT; SFB 1002 TP C04 per MT e WHZ; SFB 1002 TP S01 per WHZ; e EXC 2067/1-390729940J per WHZ). WHZ è sostenuto dal Ministero federale tedesco per la scienza e l’istruzione (BMBF attraverso il progetto IndiHEART) e dalla Fondation Leducq (20CVD04). MT, WHZ e SL sono supportati dal Centro tedesco per la ricerca cardiovascolare (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Referências
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologia do Desenvolvimento. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

