섬유아세포, 선별 애플리케이션을 위한 인간 공학형 결합 조직
Summary
여기에 제시된 프로토콜은 기계학 연구, 질병 모델링 및 스크리닝 애플리케이션에 적합한 이중 극이 있는 다중 우물 판에서 48개의 조직의 병렬 배양에 대한 엔지니어링 된 결합 조직을 생성하는 프로토콜입니다. 프로토콜은 다른 장기와 종에서 섬유 아세포와 호환되며 인간의 기본 심장 섬유 아세포와 함께 여기에 예시됩니다.
Abstract
섬유아세포는 전형적으로 매우 역동적인 세포로 생화학적 및 생화학적 자극에 대응하여 심섬유아세포로 빠르게 분화합니다. 심장 섬유증을 포함한 섬유성 과정의 현재 이해는 가난한 남아, 이는 새로운 항 섬유 치료의 개발을 방해. 제어 가능하고 신뢰할 수 있는 인간 모델 시스템은 섬유증 병리학을 더 잘 이해하기 에 매우 중요합니다. 이것은 섬유아세포와 3차원(3D) 환경에서 섬유아세포및 섬유조직의 병리생리학에 대한 연구를 용이하게 하기 위해 48웰 주조 판에서 엔지니어링된 결합 조직(ECT)을 생성하는 매우 재현가능하고 확장 가능한 프로토콜이다. ECT는 정의 된 생체 기계적 부하하에서 연구를 허용, 튜닝 강성으로 극 주위에 생성됩니다. 정의된 로딩 조건하에서 세포 매트릭스 상호 작용에 의해 제어되는 현상 적응을 연구할 수 있습니다. 병렬 테스트는 48웰 형식으로 가능하며, 부하에 대한 조직 압축 및 수축과 같은 여러 매개 변수의 시간 과정 분석을 위한 기회를 제공합니다. 이러한 파라미터로부터 조직 강성 및 탄성과 같은 생체 역학적 특성을 연구할 수 있다.
Introduction
섬유성 질환의 연구에 있는 중요한 장애물은 섬유아세포및 그들의 병리학 적인 유도체의 행동에 통찰력을 제공하는 대표적인 인간 3D 조직 모형의 부족입니다. 섬유질 공정을 연구하기 위해, 표준 2D 배양 시스템은 분리된 섬유아세포가 비준수 2D 기판에서 배양할 때 α 부드러운 근육 액틴(SMA)으로 빠르게 변형되기 때문에 최적이 다합니다1,2,3. 따라서, 표준 2D 배양에서 섬유아세포는 규칙적인 “건강한” 조직 표현형을 반영하지 않는다3,4,5,6. 유연한 기판에 배양비(10kPa) 및 섬유성(35kPa) 조직 환경을 시뮬레이션하기 위해 도입되었지만, 병리생리학에 있어서 매우 중요한 제3차원이 부족하다. 조직 공학은 정의되고 실험적으로 튜닝할 수 있는 세포외 매트릭스(ECM)-컨텍스트에서 섬유아세포 배양을 허용함으로써 이러한 한계를 극복할 수 있는 기회를 제공하며, 예를 들어 세포성, ECM 조성 및 ECM 농도의 변경에 의해 조직 생체 역학을 결정할 수 있다.
섬유아세포를 사용하여 다양한 3D 모델이 생성되었습니다. 부동 디스크와 마이크로스피어는 첫 번째 디스크 중 하나였으며 콜라겐이 시간에 따라 리모델링되고 압축된다는 것을 보여줍니다. 섬유아세포는 콜라겐 피브릴에 견인력을 발휘하며, 성장 인자 베타 1(TGF-β1)을 변형시키는 것과 같은 프로 섬유성 제제의 첨가에 의해 촉진될 수 있는 과정입니다.8,9,10,11,12,13,14,15,16. 그러나 자유롭게 부동 배양은 제어된 외부 로딩을 허용하지 않으므로 지속적으로 축소 또는 압축 모델을 구성합니다. 시트와 같은 엔지니어링 조직은 조직의 생체 역학 적 특성, 즉 유니, bi, 다차축 또는 순환 균주 테스트를 통해 동종 적 특성을 연구 할 수있는 가능성을 열었습니다.17,18,19,20. 이러한 모델은 세포 골격 무결성 및 actomyosin 세포 골격 수축과 긍정적으로 상관 관계를 발견 된 조직 강성에 세포 수의 영향을 입증하기 위해, 예를 들어, 사용되었습니다18,19. 그러나 힘 변환기 및 앵커 포인트의 클램프 포인트 주변의 비 균일한 조직 변형에 의해 강제-균주 변환이 복잡하다는 점에 유의해야 합니다. 이 고유의 제한은 개 뼈 또는 고리 모양의 조직에 의해 우회 될 수 있습니다, 앵커 지점에서 일부 조직 집행을 제공21,22,23. 링 모양의 조직은 세포 콜라겐 하이드로겔을 링 모양의 금형에 분배하여 제조할 수 있습니다. 하이드로겔이 컴팩트함에 따라, 조직은 금형의 압축할 수 없는 내부 막대 주위에 형성되며, 이는 추가 조직 수축을 위한 저항을 제공합니다.24,25,26,27. 초기 및 전형적으로 최대 다짐 후, 조직은 정의된 조직 길이에서 원형 ECT를 더 억제하기 위해 조절 가능한 스페이서로 옮겨질 수도 있습니다.3,24,25,26,27,28,29,30. 생물물리학적 특성은 단방향 또는 동적 변형 하에서 적절한 부하 세포를 가진 표준 수평 또는 수직 변형 응력 장치에서 평가될 수 있습니다.3. 조직은 크게 균일 한 원형 구조를 가지고 있으며 바 / 후크 (앵커리지 포인트 및 / 또는 힘 변환기)에 보유 할 수 있기 때문에, 이들은 여전히 로딩 바 주위에 압축 영역을 둘러싸고 있지만, 이 형식은 클램핑에 비해 더 균일 한 변형을 허용3. 더욱이, 고정된 조직은 양극성 세포 모양을 유도하고, 세포는 이소성 견인을 촉진하는 힘 선을 따라 신장에 의해 조직력에 적응합니다31,32,33,34,35,36. 우리는 이전에 기능적인 긴장 긴장 실험에 있는 단 하나 뻣뻣한 극의 주위에 쥐와 인간 적인 심장 섬유아세포 (CF)에서 고리 모양 ECT를 적용하고 바이러스성 으로 변환된 섬유아세포를 사용하여 기능 연구의 이득 그리고 손실을 수행했습니다24,25,26 약리학 연구37. 추가, 우리는 ECT 모형에 있는 CF 매개한 섬유증에 있는 성다름을 확인할 수 있었습니다27.
상용 벤더( 자료 표 참조)에서 극저온 보존 CF로 획득한 1차 인간 CF로 본보기인 인간 ECT 생성을 위한 다음 프로토콜은 링 형 조직의 장점을 병렬 고콘텐츠 테스트를 위해 설계된 48웰 플랫폼을 위한 거시적 조직을 쉽게 생성하는 방법과 결합합니다.
중요한 것은, ECT 모형은 그밖 섬유아세포, 예를 들면, 피부 섬유아세포38,39의 조사에서 문서화된 사용과 함께 특정 섬유아세포 모형에 제한되지 않습니다. 더욱이, 환자의 생검에서 섬유아세포는 동등하게 잘 작동하고, 섬유아세포의 선택은 궁극적으로 해결될 과학적 질문에 달려 있습니다.
본 프로토콜에 기재된 ECT의 생성에 사용되는 플랫폼은 시판되는 48웰 3D 세포/조직 배양 플레이트(도 1A)이다. 48웰 플레이트의 도움으로 정의된 형상 및 기계적 부하하에서 ECT 형성 및 기능을 제조, 배양 및 모니터링하는 방법이 설명되어 있습니다. 형성된 ECT는 통합된 플렉시블 폴에 의해 유지되며, 기계적 하중은 서로 다른 경도(Shore A 값 36-89)를 사용하여 최종 목적에 따라 미세 조정될 수 있으며, 굽힘 강성에 영향을 가합니다. 해안A 값이 46인 폴을 추천합니다. 또한 이 프로토콜은 이전에 설명된 사용자 지정 원형 몰드와 호환되며, 여기서 ECT는 단일 뻣뻣한 rod37 주위에 유지된다. 이 금형의 치수는 그림 1B에 부여됩니다.
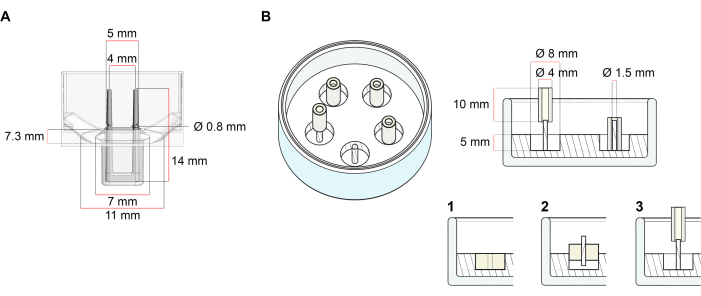
그림 1: 주조 금형의 회로도 표현. (A) 두 개의 유연한 기둥이 있는 주조 금형의 기술 도면 및 치수. 금형은 금형의 본체에서 이중 옹열극을 고정하는 짧은 벽에 의해 구분된 내부 둘레로 구성됩니다. 유연한 기둥은 서로 자유로운 수평 거리를 가지며 베이스에 연결되어 있습니다. 금형은 180 μL 주조 부피를 허용합니다. 각 금형의 우물은 배양 매체의 최소 600 μL의 부피 용량을 허용합니다. 다른 재료 조성물은 특정 강성을 가진 극을 생성하는 데 사용할 수 있습니다 (예를 들어, TM5MED-TM9MED). (B) 하나의 딱딱한 막대가 있는 링 모양의 금형의 기술 도면 및 치수. 이것은 ECT 주조 프로토콜37과 함께 사용할 수있는 뚜렷한 형상 및 기계적 환경을 가진 대체 금형입니다. 링 모양의 금형 조립 방법은 게시된 더 큰 형식28,41에서 적용되었습니다. 간단히 말해서, 이 방법은 (1) 폴리테트라플루오로틸렌(PTFE) 성형 스페이서(직경 8mm)를 폴리디메틸실록산(PDMS, 실리콘)으로 유리 접시(직경 60mm)로 부은, (2) PDMS 폴 홀더(1.5mm 직경)를 중앙에 고정하는 등(3mm)의 직경을 유지한다. 중공 공간 결과물은 180μL의 주조 부피를 허용합니다. 각 유리 접시는 여러 각각 금형 (예시 적으로 5 금형으로 표시)을 결합 할 수 있으며 배양 매체의 최대 5 mL에 대한 용량을 가지고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
제시된 프로토콜은 1 차인간 CF에서 ECT의 생성을 기술합니다, 이는 그들의 세포외 매트릭스 환경에 이 세포의 기계적 충격을 공부하고 그 반대의 경우도 마찬가지입니다.
섬유아세포는 계획된 ECT 실험(0.75 x 106 세포/ECT)에 충분한 세포를 산출하기 위해 확장될 필요가 있다. 최상의 재현성을 위해, 2D 단층 배양에서 냉동 또는 조직 유래 섬유아세포를 각 통로 내에서 최대…
Declarações
The authors have nothing to disclose.
Acknowledgements
이 작품은 독일 심장 학회 (GLS를 위한 DGK 연구 펠로우십)와 독일 연구 재단(GLS 및 AD를 위한 IRTG 1816 프로젝트를 통해 DFG)에 의해 지원되었습니다. DFG 417880571 및 DFG TI 956/1-1 MT; MT 및 WHZ에 대한 SFB 1002 TP C04; WHZ에 대한 SFB 1002 TP S01; 및 WHZ에 대한 EXC 2067/1-390729940J). WHZ는 독일 연방 과학 교육부(프로젝트 IndiHEART를 통해 BMBF)와 독주 레두크(20CVD04)의 지원을 받고 있습니다. MT, WHZ 및 SL은 독일 심장 혈관 연구 센터 (DZHK)에 의해 지원됩니다.
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Referências
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologia do Desenvolvimento. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

