समरूप मनका-आधारित परख का उपयोग करके चैपरोन-कोचेपरोन इंटरैक्शन का अध्ययन
Summary
यह प्रोटोकॉल जीएसटी-फ्यूज्ड टीपीआर-आकृति सह-चैपरनेस और स्वीकारकर्ता मोतियों के साथ ग्लूटाथिएक-लिंक्ड डोनर मोतियों का उपयोग करके प्रोटीन-प्रोटीन इंटरैक्शन की जांच करने के लिए एक तकनीक प्रस्तुत करता है जो Hsp90-व्युत्पन्न पेप्टाइड के साथ मिलकर होता है। हमने इस तकनीक का उपयोग Hsp90-FKBP51 या Hsp90-FKBP52 इंटरैक्शन को बाधित करने के लिए छोटे अणुओं को स्क्रीन करने के लिए किया है और शक्तिशाली और चयनात्मक Hsp90-FKBP51 इंटरैक्शन अवरोधकों की पहचान की है।
Abstract
हीट शॉक प्रोटीन 90 (एचएसपी90) को लक्षित करना- कोचेपेरोन इंटरैक्शन विशेष रूप से एचएसपी 90-निर्भर इंट्रासेलुलर प्रक्रियाओं को विनियमित करने की संभावना प्रदान करता है। Hsp90 के सी-टर्मिनस में संरक्षित MEEVD पेंटेपिड सह-चैपरोन्स के टेट्राट्राट्राट्रिकोपेप्टाइड रिपीट (टीपीआर) आकृति के साथ बातचीत के लिए जिम्मेदार है। FK506-बाध्यकारी प्रोटीन (FKBP) 51 और FKBP52 दो समान टीपीआर-आकृति सह-विभिन्न कार्यों के साथ स्टेरॉयड हार्मोन पर निर्भर रोगों में शामिल chaperones हैं। इसलिए, विशेष रूप से Hsp90 और FKBP51 या FKBP52 के बीच बातचीत को अवरुद्ध अणुओं की पहचान कई मानव रोगों के लिए एक आशाजनक चिकित्सीय क्षमता प्रदान करता है । यहां, हम Hsp90 और उसके साथी सह-chaperones FKBP51 और FKBP52 के बीच बातचीत की जांच करने के लिए एक प्रवर्धित ल्यूमिनेसेंट निकटता समरूप परख के लिए प्रोटोकॉल का वर्णन करते हैं। सबसे पहले, हमने ग्लूटाथिएक एस-ट्रांसफरेज (जीएसटी) टैग किए गए फॉर्म में टीपीआर आकृति युक्त प्रोटीन FKBP51 और FKBP52 को शुद्ध किया है। जीएसटी-फ्यूज्ड टीपीआर-मोटिफ प्रोटीन और स्वीकारकर्ता मोतियों के साथ ग्लूटाथिएक से जुड़े दाता मोतियों का उपयोग करते हुए एचएसपी90 के 10-मेर सी-टर्मिनल पेप्टाइड के साथ मिलकर, हमने एक सजातीय वातावरण में प्रोटीन-प्रोटीन इंटरैक्शन की जांच की है। हमने इस परख का उपयोग Hsp90-FKBP51 या Hsp90-FKBP52 बातचीत को बाधित करने के लिए छोटे अणुओं को स्क्रीन करने के लिए किया है और शक्तिशाली और चयनात्मक Hsp90-FKBP51 बातचीत अवरोधकों की पहचान की है ।
Introduction
आणविक चैपरेन प्रोटीन फोल्डिंग, परिवहन और गिरावट सहित प्रोटीन होरोस्टेसिस में योगदान देते हैं। वे कई सेलुलर प्रक्रियाओं को विनियमित करते हैं और कैंसर और न्यूरोडीजेनेरेटिव रोगों जैसे कई रोगों से जुड़े होते हैं1. हीट शॉक प्रोटीन 90 (एचएसपी 90) सबसे महत्वपूर्ण चैपरोन्स में से एक है जिसका कार्य एटीपी हाइड्रोलिसिस द्वारा संचालित अनुरूप परिवर्तनों पर निर्भर है और इसके सह-चैपरोन्स2द्वारा मध्यस्थता किए गए ग्राहक प्रोटीन के साथ बाध्यकारी है। चिकित्सकीय लक्ष्य के रूप में Hsp90 की एक स्पष्ट क्षमता के बावजूद, ठीक ट्यूनिंग अपने कार्य एक बड़ी चुनौती का प्रतिनिधित्व करता है । एन-टर्मिनल एटीपी बाध्यकारी क्षेत्र को लक्षित करने वाले कई Hsp90 अवरोधक हैं, जिनका नैदानिक परीक्षणों में मूल्यांकन किया गया है, लेकिन उनमें से किसी को भी विपणन3के लिए अनुमोदित नहीं किया गया है। एक सुपरिभाषित लिगांड-बाइंडिंग पॉकेट4की कमी के कारण, एचएसपी90 के सी-टर्मिनल क्षेत्र को लक्षित करने में सीमित सफलता मिली है4। हाल ही में, छोटे अणुओं द्वारा Hsp90-cochaperone बातचीत के व्यवधान की जांच एक वैकल्पिक रणनीति5के रूप में की गई है । Hsp90-cochaperone बातचीत को लक्षित करने से सामान्य सेल तनाव प्रतिक्रिया प्राप्त नहीं होगी और विभिन्न इंट्रासेलुलर प्रक्रियाओं को विशेष रूप से विनियमित करने की संभावना प्रदान की जाती है। Hsp90 के सी-टर्मिनस में संरक्षित एमईवीडी पेंटेपिड सह-चैपरोन्स6के टेट्राट्राइकोपेप्टाइड रिपीट (टीपीआर) आकृति के साथ बातचीत के लिए जिम्मेदार है। मानव प्रोटीन डेटाबेस में एनोटेटेड 736 टीपीआर आकृति युक्त प्रोटीन में से, ~ 20 विभिन्न प्रोटीन इस पेप्टाइड 7 के माध्यम सेएचएसपी90के साथ बातचीत करते हैं। MEEVD पेप्टाइड-बाइंडिंग के लिए प्रतिस्पर्धा करने वाले अणु एचएसपी 90 और टीपीआर डोमेन वाले सह-चैपरनेस के बीच बातचीत को बाधित करेंगे। पेप्टाइड बाध्यकारी साइट में समान तृतीयक संरचना है लेकिन विभिन्न टीपीआर आकृति डोमेन के बीच समग्र होमोलॉजी अपेक्षाकृत कमहै,जो विशेष रूप से एचएसपी 90 और विशेष टीपीआर-मोटिफ सह-चैपरनेस के बीच बातचीत को अवरुद्ध करने में सक्षम अणुओं की पहचान करने का अवसर प्रदान करता है। इन टीपीआर-आकृति सह-चैपरोन्स, FK506-बाध्यकारी प्रोटीन (FKBP) ५१ और FKBP52 स्टेरॉयड हार्मोन रिसेप्टर (SHR) संकेत के नियामकों और कैंसर, तनाव से संबंधित रोगों, चयापचय रोगों, और अल्जाइमर रोग8सहित कई स्टेरॉयड हार्मोन पर निर्भर रोगों में शामिल हैं । हालांकि FKBP51 और FKBP52 शेयर ८०% अनुक्रम समानता >, उनके कार्यों में अंतर: FKBP52 SHR गतिविधि का एक सकारात्मक नियामक है, जबकि FKBP51 ज्यादातर मामलों में एक नकारात्मक नियामक है8। इसलिए, अणुओं की पहचान करना, विशेष रूप से Hsp90 और FKBP51 या FKBP52 के बीच बातचीत को अवरुद्ध करना, संबंधित बीमारियों के लिए एक आशाजनक चिकित्सीय क्षमता प्रदान करता है।
एकmplified Luminescent पीroximity एचomogenous एकssay (अल्फास्क्रीन) पहली बार १९९४ में Ullman EF एट अल9द्वारा विकसित किया गया था । अब इसका व्यापक रूप से विभिन्न प्रकार के जैविक संपर्कों का पता लगाने के लिए प्रयोग किया जाता है, जैसे पेप्टाइड10,प्रोटीन11,डीएनए12,आरएनए13और चीनी14। इस तकनीक में दो तरह के मोतियों (व्यास 200 एनएम) हैं, एक है डोनर मनका और दूसरा है स्वीकार्य मनका। जैव अणुओं को इन मोतियों पर स्थिर किया जाता है; उनकी जैविक बातचीत दाता और स्वीकारकर्ता मोती निकटता में लाती है। 680 एनएम पर, दाता मनका में एक फोटोसेंसिटाइजर रोशन और एकल ऑक्सीजन के लिए ऑक्सीजन परिवर्तित करता है। क्योंकि सिंगलेट ऑक्सीजन का एक छोटा जीवनकाल होता है, इसलिए यह केवल 200 एनएम तक ही फैल सकता है। यदि स्वीकार्य मनका निकटता में है, तो इसका थिऑक्सीन डेरिवेटिव 370 एनएम पर सिंगलेट ऑक्सीजन उत्पन्न करने वाले रसायन के साथ प्रतिक्रिया करता है। यह ऊर्जा 520-620 एनएम15पर प्रकाश उत्सर्जित करने के लिए एक ही स्वीकार्य मनका में फ्लोरोफोरस को और सक्रिय करती है। यदि जैविक बातचीत बाधित होती है, तो स्वीकार्य मनका और दाता मनका निकटता तक नहीं पहुंच सकते हैं, जिसके परिणामस्वरूप एकल ऑक्सीजन क्षय और कम उत्पादित संकेत होते हैं।
यहां हम एचएसपी 90 और टीपीआर सह-चैपरनेस, विशेष रूप से एफकेबीपी51 और एफकेबीपी52 के बीच बातचीत को बाधित करने वाले छोटे अणुओं को स्क्रीनिंग के लिए इस तकनीक का उपयोग करके एक प्रोटोकॉल का वर्णन करते हैं। Hsp90 चरम सी-टर्मिनस के अनुरूप 10 अमीनो एसिड लांग पेप्टाइड्स स्वीकारकर्ता मोतियों से जुड़े होते हैं। शुद्ध जीएसटी-टैग टीपीआर सह-चैपरोन ग्लूटाथिएक से जुड़े दाता मोतियों के साथ बातचीत करते हैं। जब Hsp90-व्युत्पन्न पेप्टाइड्स और टीपीआर-आकृति सह-चैपरेन्स के बीच बातचीत मोतियों को एक साथ लाती है, तो एक प्रवर्धित संकेत(चित्रा 1 ए)का उत्पादन किया जाता है। यदि जांच किए गए छोटे अणु Hsp90 और टीपीआर-आकृति सह-चैपरनेस के बीच बातचीत को रोक सकते हैं, तो इस प्रवर्धित संकेत(चित्रा 1 बी)को कम कर दिया जाएगा। उनके आईसी50 की गणना मात्रात्मक माप द्वारा की जा सकती है। इस प्रोटोकॉल को किसी भी चैपरोन – टीपीआर-मोटिफ सह-चैपरवन इंटरैक्शन ऑफ इंटरेस्ट तक बढ़ाया जा सकता है और उपन्यास अणुओं के विकास में बहुत महत्व रखता है, विशेष रूप से एचएसपी 90 और एफकेबीपी51 या एफकेबीपी52 के बीच बातचीत को अवरुद्ध करता है।
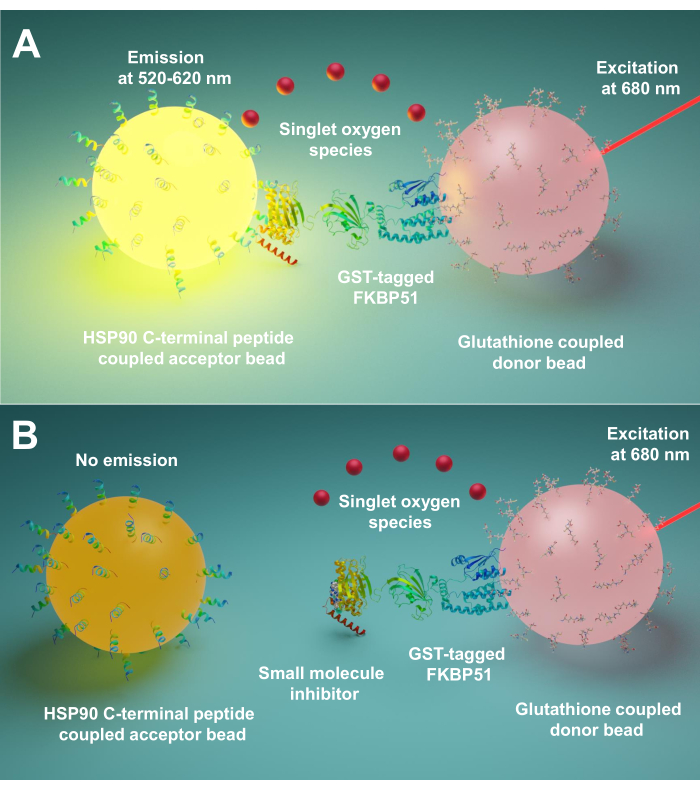
चित्र 1:इस परख का मूल सिद्धांत। (एक)शुद्ध जीएसटी-FKBP51 ग्लूटाथिएक से जुड़े दाता मोतियों के साथ बातचीत करता है । Hsp90 के चरम सी-टर्मिनस के अनुरूप 10 अमीनो एसिड लांग पेप्टाइड्स स्वीकारकर्ता मोतियों से जुड़े होते हैं। FKBP51 के Hsp90-व्युत्पन्न पेप्टाइड्स और टीपीआर डोमेन के बीच बातचीत दाता और स्वीकारकर्ता मोती निकटता में लाता है । 680 एनएम पर, दाता मनका में एक फोटोसेंसिटाइजर रोशन और एकल ऑक्सीजन के लिए ऑक्सीजन परिवर्तित करता है। स्वीकारकर्ता मनका पर थिऑक्सीन व्युत्पन्न एकल ऑक्सीजन के साथ प्रतिक्रिया करता है और 370 एनएम पर रसायनिनेसेंस उत्पन्न करता है। यह ऊर्जा 520-620 एनएम पर प्रकाश उत्सर्जित करने के लिए एक ही स्वीकार्य मनका में फ्लोरोफोरस को सक्रिय करती है। (ख)जब छोटे अणु एचएसपी90 और एफकेबीपी51 के बीच बातचीत को रोकते हैं, तो दाता और स्वीकार्य मोती निकटता तक नहीं पहुंच सकते हैं । फिर छोटे जीवनकाल क्षय के साथ सिंगलेट ऑक्सीजन, और कोई पता लगाने योग्य संकेत का उत्पादन किया जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
यहां हम एचएसपी 90 और टीपीआर-आकृति सह-चैपरनेस, विशेष रूप से FKBP51 और FKBP52 के बीच बातचीत को बाधित करने वाले छोटे अणुओं की स्क्रीनिंग के लिए परख का उपयोग करके एक प्रोटोकॉल का वर्णन करते हैं। इसका उच्च जेड स्कोर (>0.8) …
Declarações
The authors have nothing to disclose.
Acknowledgements
इस अध्ययन स्वीडिश अनुसंधान परिषद (2018-02843), ब्रेन फाउंडेशन (Fo 2019-0140), कारोलिंस्का इंस्टीट्यूट, गनवर और जोसेफ एनर्स फाउंडेशन, मैग्नस बर्गवेल्स फाउंडेशन, गन और बर्टिल स्टोहन्स फाउंडेशन, चिकित्सा अनुसंधान के लिए फाड़ निल्सन फाउंडेशन, मार्गरेटा अफग्ग्लास फाउंडेशन और फाउंडेशन में बुढ़ापे की बीमारियों के लिए फाउंडेशन द्वारा समर्थित था।
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Referências
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

