Studier av Chaperone-Cochaperone interaksjoner ved hjelp av homogen perlebasert analyse
Summary
Denne protokollen presenterer en teknikk for å undersøke proteinproteininteraksjoner ved hjelp av glutathione-tilknyttede donorperler med GST-smeltet TPR-motiv co-chaperones og akseptorperler kombinert med et Hsp90-avledet peptid. Vi har brukt denne teknikken til å screene små molekyler for å forstyrre Hsp90-FKBP51 eller Hsp90-FKBP52 interaksjoner og identifisert potente og selektive Hsp90-FKBP51 interaksjonshemmere.
Abstract
Målretting av varmesjokkproteinet 90 (Hsp90)-cochaperone interaksjoner gir mulighet til å spesifikt regulere Hsp90-avhengige intracellulære prosesser. Den konserverte MEEVD pentapeptide på C-terminus av Hsp90 er ansvarlig for samspillet med tetratricopeptide repeat (TPR) motiv av co-chaperones. FK506-bindende protein (FKBP) 51 og FKBP52 er to lignende TPR-motiv co-chaperones involvert i steroidhormonavhengige sykdommer med forskjellige funksjoner. Derfor gir identifisering av molekyler som spesifikt blokkerer interaksjoner mellom Hsp90 og FKBP51 eller FKBP52 et lovende terapeutisk potensial for flere menneskelige sykdommer. Her beskriver vi protokollen for en forsterket luminescerende nærhet homogen analyse for å sondere interaksjoner mellom Hsp90 og partnerkollegaene FKBP51 og FKBP52. For det første har vi renset TPR-motivholdige proteiner FKBP51 og FKBP52 i glutathione S-transferase (GST)-merket form. Ved hjelp av glutathione-tilknyttede donorperler med GST-smeltet TPR-motivproteiner og akseptorperler kombinert med et 10-mer C-terminal peptid av Hsp90, har vi undersøkt proteinproteininteraksjoner i et homogent miljø. Vi har brukt denne analysen til å screene små molekyler for å forstyrre Hsp90-FKBP51 eller Hsp90-FKBP52 interaksjoner og identifisert potente og selektive Hsp90-FKBP51 interaksjonshemmere.
Introduction
Molekylære anstander bidrar til protein homeostase, inkludert proteinfolding, transport og nedbrytning. De regulerer flere cellulære prosesser og er knyttet til mange sykdommer som kreft og nevrodegenerative sykdommer1. Varmesjokkprotein 90 (Hsp90) er en av de viktigste anstandene hvis funksjon er avhengig av konformasjonsendringer drevet av ATP hydrolyse og binding med klientproteiner mediert av sine medprester2. Til tross for et åpenbart potensial for Hsp90 som terapeutisk mål, representerer finjustering av funksjonen en stor utfordring. Det er flere Hsp90-hemmere rettet mot N-terminal ATP-bindingsregionen, som har blitt evaluert i kliniske studier, men ingen av dem er godkjent for markedsføring3. På grunn av mangelen på en veldefinert ligandbindingslomme4, har målretting av C-terminalområdet Hsp90 hatt begrenset suksess4. Nylig har forstyrrelse av Hsp90-cochaperone interaksjoner av små molekyler blitt undersøkt som en alternativ strategi5. Målretting av Hsp90-cochaperone interaksjoner ville ikke fremkalle generell celle stress respons og gir mulighet til å spesifikt regulere ulike intracellulære prosesser. Den konserverte MEEVD pentapeptide på C-terminus av Hsp90 er ansvarlig for samspillet med tetratricopeptide repeat (TPR) motiv av co-chaperones6. Av de 736 TPR-motivholdige proteinene som er kommentert i den menneskelige proteindatabasen, samhandler ~ 20 forskjellige proteiner med Hsp90 via dettepeptidet 7. Molekyler som konkurrerer om MEEVD peptidbinding vil forstyrre interaksjonene mellom Hsp90 og medprester som inneholder et TPR-domene. Peptidbindingsstedet har lignende tertiær struktur, men den generelle homologien mellom forskjellige TPR-motivdomener er relativt lav7, noe som gir en mulighet til å identifisere molekyler som er spesielt i stand til å blokkere interaksjoner mellom Hsp90 og spesielle TPR-motiv co-chaperones. Blant disse TPR-motiv co-chaperones, FK506-bindende protein (FKBP) 51 og FKBP52 er regulatorer av steroid hormon reseptor (SHR) signalering og involvert i flere steroidhormonavhengige sykdommer inkludert kreft, stress-relaterte sykdommer, metabolske sykdommer, og Alzheimers sykdom8. Selv om FKBP51 og FKBP52 deler > 80% sekvenslikhet, varierer deres funksjoner: FKBP52 er en positiv regulator for SHR-aktivitet, mens FKBP51 er en negativ regulator i de fleste tilfeller8. Derfor gir identifisering av molekyler, spesielt blokkering av interaksjoner mellom Hsp90 og FKBP51 eller FKBP52, et lovende terapeutisk potensial for relaterte sykdommer.
Enmplified Luminescent Proximity Homogen Assay (AlphaScreen) ble først utviklet i 1994 av Ullman EF et al.9. Nå er det mye brukt til å oppdage forskjellige typer biologiske interaksjoner, for eksempel peptid10, protein11, DNA12, RNA13og sukker14. I denne teknikken er det to typer perler (diameter 200 nm), den ene er donorperlen og den andre er akseptorperlen. Biomolekylene er immobilisert på disse perlene; deres biologiske interaksjoner bringer donor- og akseptorperler i nærheten. Ved 680 nm lyser en fotosensibilisator i donorperlen og konverterer oksygen til singlet oksygen. Fordi singlet oksygen har kort levetid, kan det bare diffusere opptil 200 nm. Hvis akseptorperlen er i nærheten, reagerer dets tioksenderivat med singlet oksygengenererende chemiluminescens ved 370 nm. Denne energien aktiverer videre fluoroforer i samme akseptorperle for å avgi lys ved 520-620 nm15. Hvis de biologiske interaksjonene blir forstyrret, kan ikke akseptorperlen og donorperlen nå nærhet, noe som resulterer i singlet oksygenforfall og lavt produsert signal.
Her beskriver vi en protokoll ved hjelp av denne teknikken for screening av små molekyler som hemmer interaksjoner mellom Hsp90 og TPR co-chaperones, spesielt FKBP51 og FKBP52. De 10 aminosyre lange peptidene som tilsvarer Hsp90 ekstrem C-terminus er festet til akseptorperler. Renset GST-merket TPR co-chaperones samhandler med glutathione-tilknyttede donorperler. Når samspillet mellom Hsp90-avledede peptider og TPR-motiv co-chaperones bringer perlene sammen, produseres et forsterket signal (Figur 1A). Hvis de screenede små molekylene kan hemme interaksjonene mellom Hsp90 og TPR-motiv co-chaperones, vil dette forsterkede signalet bli redusert (Figur 1B). Deres IC50 kan beregnes ved kvantitativ måling. Denne protokollen kan utvides til enhver anstand – TPR-motiv co-chaperone interaksjoner av interesse og er av stor betydning i utviklingen av nye molekyler, spesielt blokkerer samspillet mellom Hsp90 og FKBP51 eller FKBP52.
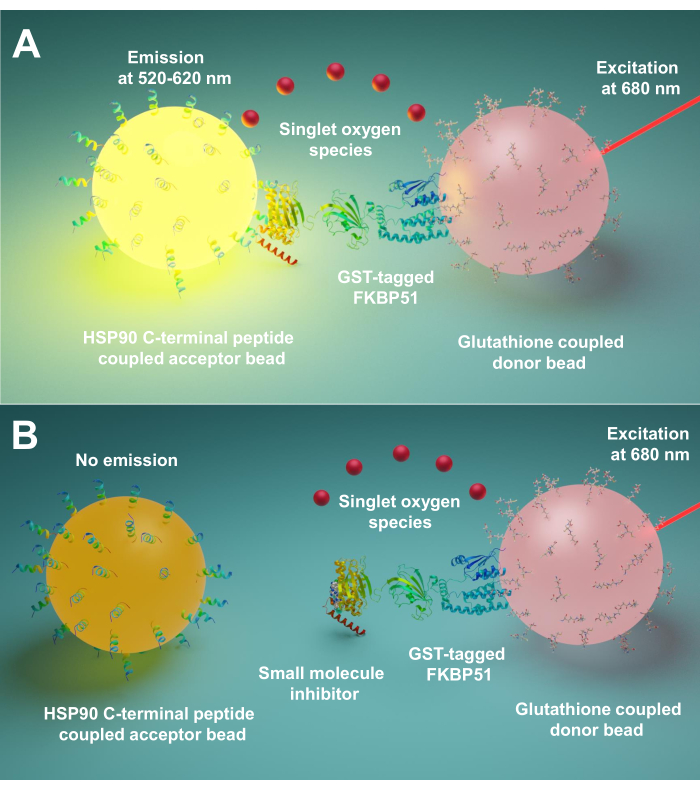
Figur 1: Det grunnleggende prinsippet i denne analysen. (A) Renset GST-FKBP51 samhandler med glutathione-tilknyttede donorperler. De 10 aminosyre lange peptidene som tilsvarer den ekstreme C-terminus av Hsp90 er festet til akseptorperler. Samspillet mellom Hsp90-avledede peptider og TPR-domenet til FKBP51 bringer donor- og akseptorperlene i nærheten. Ved 680 nm lyser en fotosensibilisator i donorperlen og konverterer oksygen til singlet oksygen. Tioksenderivatet på akseptorperlen reagerer med singlet oksygen og genererer chemiluminescens ved 370 nm. Denne energien aktiverer videre fluoroforer i samme akseptorperle for å avgi lys ved 520-620 nm. (B) Når små molekyler hemmer interaksjonene mellom Hsp90 og FKBP51, kan donor- og akseptorperler ikke nå nærhet. Deretter forfaller singlet oksygen med kort levetid, og det produseres ikke noe påviselig signal. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Her beskriver vi en protokoll ved hjelp av analysen for screening av små molekyler som hemmer interaksjoner mellom Hsp90 og TPR-motiv co-chaperones, spesielt FKBP51 og FKBP52. Den høye Z-poengsummen (>0,8) demonstrerer robustheten og påliteligheten for et format med høy gjennomstrømning. Resultatene kan oppnås innen en time, og små mengder perler, protein og forbindelser er nødvendig. Videre kan denne protokollen enkelt utvides til enhver Hsp90 / Hsp70 – TPR-motiv co-chaperone interaksjoner av interesse. Flere TP…
Declarações
The authors have nothing to disclose.
Acknowledgements
Denne studien ble støttet av tilskudd fra Det svenske forskningsrådet (2018-02843), Brain Foundation (Fo 2019-0140), Foundation for Geriatric Diseases ved Karolinska Institutet, Gunvor og Josef Anérs Foundation, Magnus Bergvalls Foundation, Gun og Bertil Stohnes Foundation, Tore Nilssons Foundation for medisinsk forskning, Margaretha af Ugglas foundation og Foundation for Old Servants.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Referências
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

