Microscopia de Fluorescência para Internalização ATP Mediada por Macropinocistose em Células tumorais humanas e camundongos tumorais-xenorgrafados
Summary
Desenvolvemos um método reprodutível para visualizar a internalização do triphosfato fluorescente nãohydrolyzável (ATP), um substituto da ATP, com alta resolução celular. Validamos nosso método usando linhas celulares tumorais in vitro e in vivo e camundongos imunodeficentes xenoenxerados com tecido tumoral humano.
Abstract
O triphosfato de adenosina (ATP), incluindo o ATP extracelular (eATP), tem mostrado desempenhar papéis significativos em vários aspectos da tumorigênese, como resistência a medicamentos, transição epitelial-mesenquimal (EMT) e metástase. O eATP intratumoral é 103 a 104 vezes maior em concentração do que em tecidos normais. Enquanto o eATP funciona como um mensageiro para ativar a sinalização purinérgica para indução de EMT, ele também é internalizado por células cancerígenas através de macropinocose regulamentada, um tipo específico de endocitose, para executar uma grande variedade de funções biológicas. Essas funções incluem fornecer energia para reações bioquímicas que requerem ATP, doar grupos de fosfato durante a transdução de sinal e facilitar ou acelerar a expressão genética como um cofator transcricional. A ATP está prontamente disponível, e seu estudo sobre câncer e outros campos, sem dúvida, aumentará. No entanto, o estudo eATP permanece em um estágio inicial, e questões não resolvidas permanecem sem resposta antes que as atividades importantes e versáteis desempenhadas pelo eATP e atp intracelular internalizada possam ser totalmente desvendadas.
As contribuições desses laboratórios para esses estudos iniciais do EATP incluem imagens microscópicas de ATP fluorescentes não hidrogáveis, juntamente com dextrans fluorescentes de alto e baixo peso molecular, que servem como rastreadores de macropinocose e endocitose, bem como vários inibidores de endocitose, para monitorar e caracterizar o processo de internalização eATP. Essa modalidade de imagem foi aplicada às linhas de células tumorais e a camundongos imunodeficentes, xenoengrafados com tumores de câncer humano, para estudar a internalização eATP in vitro e in vivo. Este artigo descreve esses protocolos in vitro e in vivo, com ênfase em modificar e afinar as condições de ensaio para que os ensaios de internalização eATP mediados pela macropinocis-/endocitose possam ser realizados com sucesso em diferentes sistemas.
Introduction
A absorção oportunista de nutrientes extracelulares intratumorais (ou seja) foi recentemente nomeada uma marca fundamental para o metabolismo do câncer1. Um desses nutrientes importantes é o ATP, pois a concentração de ieATP é 103 e 104 vezes maior do que a encontrada em tecidos normais, na faixa de várias centenas de μM a baixo mM2,3,4,5. Como uma molécula chave de energia e sinalização, a ATP desempenha um papel central no metabolismo celular em células cancerosas e saudáveis6,7,8. A ATP extracelular não está apenas envolvida no crescimento de células cancerosas, mas também promove a resistência a medicamentos9. Funções não reconhecidas anteriormente da ATP, como a atividade hidrotrópica, foram recentemente identificadas, implicando assim o envolvimento da ATP em doenças como o Alzheimer10. De fato, parece que nossa compreensão da ATP e suas funções em células cancerosas, células saudáveis e outras células doentes está longe de ser completa. No entanto, devido à instabilidade da ATP e às altas taxas de rotatividade nas células, é tecnicamente desafiador monitorar o movimento da ATP através da membrana celular e para a célula.
Para enfrentar esse problema e suprir a necessidade desta área de pesquisa, foi desenvolvido um método no qual o ATP fluorescente não higdrolyzável (NHF-ATP) (Figura 1) foi utilizado como substituto para visualizar a internalização da ATP e observar a localização espacial intracelular da ATP internalizada, tanto in vitro quanto in vivo11,12 . A NHF-ATP foi demonstrada para substituir o ATP endógeno para investigar o movimento da ATP em membranas celulares animais, tanto em linhas de células cancerosas quanto em tecido tumoral humano xenoenxerado em camundongos imunodeficentes11,12. Além disso, a administração de inibidores de macropinocise às células bloqueadas da internalização eATP, sugerindo que a absorção intracelular do eATP envolve um mecanismo macropinocistótico9,11,12. Este protocolo permite a colação imunobasada contra proteínas específicas de células e, portanto, a identificação de qual tipo de célula internaliza o NHF-ATP. Usando xenoenxertos de tumor in vivo e microscopia de alta resolução, o NHF-ATP pode ser visualizado espacialmente através da amostra de tecido e até mesmo dentro de uma única célula. Esses métodos também permitem análise quantitativa, como o percentual de captação celular, número de vesículas macropinocitóticas e cinética de internalização. Este artigo descreve em detalhes como o NHF-ATP, trabalhando sozinho ou em conjunto com o dextrans fluorescente endocitose-tracer13,14,15,16, pode ser usado em diferentes ambientes experimentais para estudar a internalização e localização intracelular da ATP, após a internalização nas células.
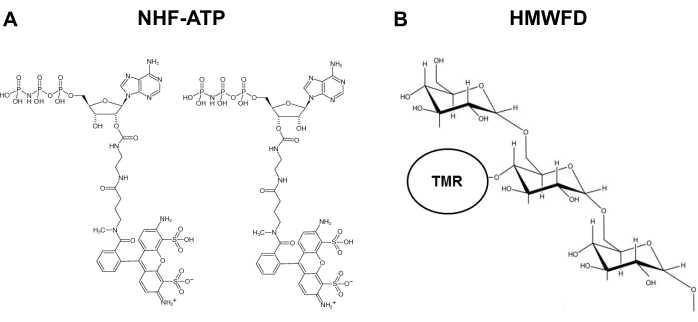
Figura 1: Estruturas de ATP fluorescente não-higrobrizável e tetrametilrhodamina rotuladas dextran fluorescente de alto peso molecular. (A) Estrutura de NHF-ATP. (B) Representação esquemática de HMWFD. Abreviaturas: ATP = triphosfato de adenosina; NHF-ATP = ATP fluorescente nãohydroable; TMR = tetrametilarhodamina; HMWFD = dextran fluorescente de alto peso molecular. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Desenvolveu-se um método para análise espacial, temporal e quantitativa da internalização celular de ATP não higdrozável. Este método é amplamente aplicável para uso em diversos sistemas biológicos, incluindo vários modelos tumorigênicos, para os quais fornecemos instruções técnicas e dados representativos. Para adquirir dados interpretáveis durante estudos de internalização in vivo ATP (seção 4 do protocolo), é fundamental limitar o tempo experimental decorrido da injeção de dextran intra…
Declarações
The authors have nothing to disclose.
Acknowledgements
Cryosectioning foi realizado no local no Núcleo histopatologia da Universidade de Ohio. Este trabalho foi apoiado em parte por fundos de start-up (Ohio University College of Arts & Sciences) para C Nielsen; NIH concede R15 CA242177-01 e prêmio RSAC para X Chen.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
Referências
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

