Echtzeit-Fluoreszenzmessung synaptischer Funktionen in Modellen der amyotrophen Lateralsklerose
Summary
Es werden zwei verwandte Methoden beschrieben, um subzelluläre Ereignisse zu visualisieren, die für die synaptische Übertragung erforderlich sind. Diese Protokolle ermöglichen die Echtzeitüberwachung der Dynamik des präsynaptischen Kalziumeinflusses und der synaptischen Vesikelmembranfusion mittels Lebendzellbildgebung von in vitro kultivierten Neuronen.
Abstract
Vor der neuronalen Degeneration ist die Ursache für motorische und kognitive Defizite bei Patienten mit amyotropher Lateralsklerose (ALS) und/oder Frontotemporallappendemenz (FTLD) eine Dysfunktion der Kommunikation zwischen Neuronen und Motoneuronen und Muskeln. Der zugrunde liegende Prozess der synaptischen Übertragung beinhaltet die membrandepolarisationsabhängige synaptische Vesikelfusion und die Freisetzung von Neurotransmittern in die Synapse. Dieser Prozess geschieht durch lokalisierten Kalziumeinstrom in die präsynaptischen Terminals, in denen sich synaptische Vesikel befinden. Hier beschreibt das Protokoll fluoreszenzbasierte Live-Imaging-Methoden, die zuverlässig depolarisationsvermittelte synaptische Vesikelexozytose und präsynaptische terminale Kalziumeinflussdynamik in kultivierten Neuronen melden.
Mit einem Styrylfarbstoff, der in synaptische Vesikelmembranen eingearbeitet wird, wird die synaptische Vesikelfreisetzung aufgeklärt. Auf der anderen Seite, um den Eintritt von Kalzium zu untersuchen, wird Gcamp6m verwendet, ein genetisch kodierter fluoreszierender Reporter. Wir verwenden eine hohe Kaliumchlorid-vermittelte Depolarisation, um die neuronale Aktivität nachzuahmen. Um die synaptische Vesikelexozytose eindeutig zu quantifizieren, messen wir den Verlust der normalisierten Styrylfarbstofffluoreszenz als Funktion der Zeit. Unter ähnlichen Stimulationsbedingungen, im Falle eines Kalziumeinflusses, nimmt die Gcamp6m-Fluoreszenz zu. Die Normalisierung und Quantifizierung dieser Fluoreszenzänderung erfolgt ähnlich wie das Styrylfarbstoffprotokoll. Diese Methoden können mit transfektionsbasierter Überexpression fluoreszenzmarkierter mutierter Proteine gemultiplext werden. Diese Protokolle wurden ausgiebig verwendet, um synaptische Dysfunktion in Modellen von FUS-ALS und C9ORF72-ALS unter Verwendung von primären kortikalen und motorischen Neuronen von Nagetieren zu untersuchen. Diese Protokolle ermöglichen ein schnelles Screening von Verbindungen, die die neuronale Kommunikation verbessern können. Daher sind diese Methoden nicht nur für das Studium von ALS, sondern für alle Bereiche der neurodegenerativen und entwicklungsneurowissenschaftlichen Forschung wertvoll.
Introduction
Die Modellierung der amyotrophen Lateralsklerose (ALS) im Labor ist aufgrund der überwiegend sporadischen Natur von über 80 % der Fälle1 in Verbindung mit der großen Anzahl genetischer Mutationen, von denen bekannt ist, dass sie krankheitserregend sind2, eine einzigartige Herausforderung2. Trotzdem haben alle Fälle von ALS das verbindende Merkmal gemeinsam, dass es vor der vollständigen neuronalen Degeneration zu einer dysfunktionalen Kommunikation zwischen präsynaptischen Motoneuronen und postsynaptischen Muskelzellen kommt3,4. Klinisch, wenn Patienten die Konnektivität der verbleibenden oberen und unteren Motoneuronen verlieren, weisen sie während der gesamten Krankheit Merkmale der neuronalen Hyper- und Hypoerregbarkeit auf5,6,7,8,9, die komplexe zugrunde liegende molekulare Veränderungen dieser Synapsen widerspiegeln, die wir als ALS-Forscher zu verstehen versuchen.
Mehrere transgene Modelle haben gezeigt, dass Verschlechterung und Desorganisation der neuromuskulären Verbindung mit der Expression von ALS-verursachenden genetischen Mutationen auftreten, einschließlich SOD110, FUS11,12, C9orf7213,14,15,16 und TDP4317,18,19 durch morphologische Bewertungen, einschließlich der Bewertung von synaptischen Boutons, Wirbelsäulendichten und prä- / postsynaptischer Organisation. Mechanistisch war es seit den bahnbrechenden Arbeiten von Cole, Hodgkin und Huxley in den 1930er Jahren auch möglich, synaptische Reaktionen durch elektrophysiologische Techniken entweder in vitro-Zellkultur oder in Gewebeschnittpräparaten zu bewerten20. Durch diese Strategien haben viele ALS-Modelle synaptische Übertragungsdefizite gezeigt. Zum Beispiel verursacht eine mutierte Variante von TDP43 eine erhöhte Feuerfrequenz und verringert die Aktionspotentialschwelle in NSC-34 (Rückenmark x Neuroblastom Hybridzelllinie 34) motorisch-neuronenähnlichen Zellen21. Dieselbe Variante verursacht auch eine dysfunktionale synaptische Übertragung an der neuromuskulären Verbindung (NMJ) vor dem Auftreten von verhaltensbedingten motorischen Defiziten in einem Mausmodell22. Es wurde zuvor gezeigt, dass die mutierte FUS-Expression in einem Drosophila-Modell von FUS-ALS vor lokomotorischen Defekten zu einer reduzierten synaptischen Übertragung am NMJ führt11. Ein kürzlich veröffentlichter Bericht unter Verwendung induzierter pluripotenter Stammzellen, die aus C9orf72-Expansionsträgern gewonnen wurden, zeigte eine Verringerung des leicht freisetzbaren Pools synaptischer Vesikel23. Insgesamt unterstreichen diese und andere Studien, wie wichtig es ist, ein umfassenderes Verständnis der Mechanismen aufzubauen, die der synaptischen Signalübertragung in krankheitsrelevanten Modellen der ALS zugrunde liegen. Dies wird entscheidend sein, um die Pathobiologie von ALS zu verstehen und potenzielle therapeutische Ziele für Patienten zu entwickeln.
Methoden der Strom- und Spannungsspannzellen waren von unschätzbarem Wert bei der Bestimmung von Membraneigenschaften wie Leitwert, Ruhemembranpotential und Quantengehalt einzelner Synapsen20,24. Eine der wesentlichen Einschränkungen der Elektrophysiologie besteht jedoch darin, dass sie technisch anspruchsvoll ist und nur Erkenntnisse von einem einzelnen Neuron gleichzeitig liefert. Die konfokale Lebendzellmikroskopie, gekoppelt mit spezifischen fluoreszierenden Sonden, bietet die Möglichkeit, die synaptische Übertragung von Neuronen räumlich-zeitlich zu untersuchen25,26,27. Obwohl dieser Fluoreszenzansatz kein direktes Maß für die neuronale Erregbarkeit ist, kann er eine relative Messung von zwei molekularen Korrelationen der synaptischen Funktion liefern: synaptische Vesikelfreisetzung und Calciumtransienten an synaptischen Terminals.
Wenn ein Aktionspotential die präsynaptische terminale Region von Neuronen erreicht, werden Calciumtransienten ausgelöst, was den Übergang von einem elektrischen Signal zum Prozess der Neurotransmitterfreisetzung erleichtert28. Spannungsgesteuerte Kalziumkanäle, die in diesen Bereichen lokalisiert sind, regulieren die Kalziumsignalisierung streng, um die Kinetik der Neurotransmitterfreisetzung zu modulieren29. Die ersten berichteten fluoreszenzbasierten Aufzeichnungen von Calciumtransienten wurden entweder mit dem Zweiwellenlängenindikator Fura-2 AM oder dem Einzelwellenlängenfarbstoff Fluo-3 AM30,31,32 durchgeführt. Während diese Farbstoffe zu dieser Zeit großartige neue Erkenntnisse boten, leiden sie unter mehreren Einschränkungen wie unspezifischer Kompartimentierung innerhalb von Zellen, aktivem oder passivem Farbstoffverlust aus markierten Zellen, Photobleichen und Toxizität, wenn sie über längere Zeiträume abgebildet werden33. In den letzten zehn Jahren sind genetisch kodierte Kalziumindikatoren zu den Arbeitspferden für die Abbildung verschiedener Formen neuronaler Aktivität geworden. Diese Indikatoren kombinieren ein modifiziertes fluoreszierendes Protein mit einem Calciumchelatorprotein, das nach der Bindung von Ca2+-Ionen schnell die Fluoreszenzintensität wechselt34. Die Anwendung dieser neuen Indikatoren ist enorm und ermöglicht eine viel einfachere Visualisierung intrazellulärer Calciumtransienten sowohl in vitro- als auch de vivo-Umgebungen. Eine Familie dieser genetisch kodierten Reporter, bekannt als GCaMP, wird jetzt breit genutzt. Diese Indikatoren enthalten eine C-terminale Calmodulindomäne, gefolgt von grün fluoreszierendem Protein (GFP), und sind durch eine N-terminale Calmodulin-Bindungsregion begrenzt35,36. Die Calciumbindung an die Calmodulindomäne löst eine Wechselwirkung mit der Calmodulin-bindenden Region aus, was zu einer Konformationsänderung der gesamten Proteinstruktur und einer erheblichen Erhöhung der Fluoreszenz der GFP-Einheit führt35,36. Im Laufe der Jahre hat diese Reporterfamilie mehrere Entwicklungen durchlaufen, um unterschiedliche Auslesungen für bestimmte Kalziumtransienten mit spezifischer Kinetik (langsam, mittel und schnell) mit jeweils leicht unterschiedlichen Eigenschaften zu ermöglichen37,38. Hier wurde die Verwendung des Reporters GcaMP6 hervorgehoben, von dem zuvor gezeigt wurde, dass er einzelne Aktionspotentiale und dendritische Calciumtransienten in Neuronen sowohl in vivo als auch in vitro nachweist37.
Calciumtransienten in der präsynaptischen Region lösen synaptische Vesikelfusionsereignisse aus, die eine Freisetzung von Neurotransmittern in die Synapse und die Initiierung von Signalereignissen in der postsynaptischen Zelle verursachen28,39. Synaptische Vesikel werden sowohl schnell freigesetzt als auch recycelt, da die Zelle homöostatisch eine stabile Zellmembranoberfläche und einen leicht lösbaren Pool fusionsfähiger membrangebundener Vesikel beibehält40. Der hier verwendete Styrylfarbstoff hat eine Affinität zu Lipidmembranen und verändert seine Emissionseigenschaften spezifisch anhand der Ordnung der umgebenden Lipidumgebung41,42. Somit ist es ein ideales Werkzeug für die Markierung von synaptischen Recyclingvesikeln und die anschließende Verfolgung dieser Vesikel, da sie später nach neuronaler Stimulation freigesetzt werden41,42. Das Protokoll, das generiert und optimiert wurde, ist eine Adaption der ursprünglich von Gaffield und Kollegen beschriebenen Konzepte, die es uns ermöglicht, styrylfarbstoffmarkierte synaptische Vesikelpunkta im Laufe der Zeit kontinuierlich zu visualisieren41.
Hier werden zwei verwandte fluoreszenzbasierte Methoden beschrieben, die zuverlässig über spezifische zelluläre Ereignisse berichten, die an der synaptischen Übertragung beteiligt sind. Protokolle wurden definiert, um die Dynamik des depolarisationsvermittelten präsynaptischen terminalen Kalziumeinflusses und der synaptischen Vesikelexozytose in kultivierten Neuronen zu untersuchen. Hier konzentrieren sich Methoden und repräsentative Ergebnisse auf die Verwendung primärer kortikaler oder motorischer Neuronen von Nagetieren als In-vitro-Modellsystem, da es veröffentlichte Studien mit diesen Zelltypen gibt43,44. Diese Methoden sind jedoch auch auf differenzierte humane i3-kortikal-ähnliche Neuronen anwendbar45, da wir auch mit beiden Protokollen in derzeit laufenden Experimenten in unserem Labor erfolgreich waren. Das allgemeine Protokoll ist in einem schrittweisen linearen Format dargestellt (siehe Abbildung 1). Kurz gesagt, um die Kalziumdynamik in Neuriten zu untersuchen, werden reife Neuronen mit Plasmid-DNA transfiziert, um den fluoreszierenden Reporter GCaMP6m unter einem Cytomegalovirus (CMV) -Promotor zu exprimieren37,46. Transfizierte Zellen haben eine geringe basale grüne Fluoreszenz, die in Gegenwart von Kalzium zunimmt. Interessante Regionen werden angegeben, um Fluoreszenzänderungen während unserer Manipulation zu überwachen. Damit lassen sich stark räumlich und zeitlich begrenzte Schwankungen des Calciums messen37,46. Zur Beurteilung der synaptischen Vesikelfusion und -freisetzung werden reife Neuronen mit Styrylfarbstoff beladen, der in synaptische Vesikelmembranen eingebaut wird, während sie in präsynaptischen Zellen recycelt, reformiert und mit Neurotransmittern wieder geladen werden41,42,43,47,48. Die aktuellen Farbstoffe, die zu diesem Zweck verwendet werden, markieren synaptische Vesikel entlang von Neuriten und werden als Proxy für diese Regionen in Live-Imaging-Experimenten verwendet, wie die gemeinsame Färbung von Styrylfarbstoff und Synaptotagmin durch Kraszewski und Kollegen gezeigt wurde49. Hier sind repräsentative Bilder ähnlicher Färbungen enthalten, die ebenfalls durchgeführt wurden (Abbildung 2A). Frühere Forscher haben solche Farbstoffe ausgiebig verwendet, um die Dynamik synaptischer Vesikel an der neuromuskulären Verbindung und den Hippocampus-Neuronen zu melden48,49,50,51,52,53,54,55,56 . Durch die Auswahl punktueller Regionen von farbstoffbeladenen Vesikeln und durch die Überwachung der Abnahme der Fluoreszenzintensität nach der Vesikelfreisetzung können die funktionelle synaptische Übertragungskapazität und die zeitliche Dynamik der Freisetzung nach Stimulation untersucht werden43. Für beide Methoden wird ein Medium verwendet, das eine hohe Konzentration an Kaliumchlorid enthält, um Zellen zu depolarisieren, um neuronale Aktivität nachzuahmen. Bildgebungsparameter werden angegeben, um Intervalle von unter einer Sekunde zu erfassen, die sich über eine Basisnormalisierung erstrecken, gefolgt von unserer Stimulationserfassungsperiode. Fluoreszenzmessungen zu jedem Zeitpunkt werden bestimmt, auf den Hintergrund normalisiert und über den experimentellen Zeitraum quantifiziert. Calcium-Influx-vermittelte GCaMP6m-Fluoreszenzerhöhung oder effektive synaptische Vesikel-Exozytose-Styryl-Farbstofffreisetzungsfluoreszenzabnahme kann durch diese Strategie nachgewiesen werden. Detaillierter methodischer Aufbau und Parameter für diese beiden Protokolle und eine Diskussion über ihre Vorteile und Grenzen werden im Folgenden beschrieben.
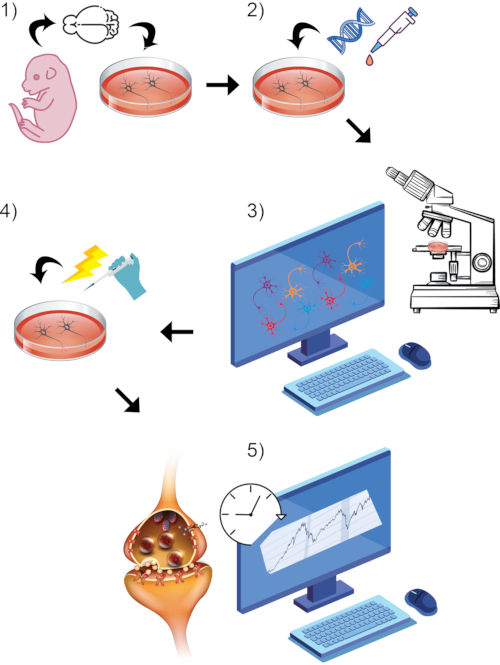
Abbildung 1: Visuelles Rendering des allgemeinen Protokollprozesses. (1) Isolieren und kultivieren Sie primäre Nagetierneuronen in vitro zum gewählten Reifungszeitpunkt. (2) Einführung von GCaMP-DNA oder Styrylfarbstoff als Reporter der synaptischen Aktivität. (3) Richten Sie das Bildgebungsparadigma mit einem mit Live-Imaging ausgestatteten Konfokalmikroskop und der zugehörigen Software ein. Beginnen Sie mit dem Baseline-Aufzeichnungszeitraum. (4) Während Zellen noch live aufgenommen werden, stimulieren sie Neuronen durch hohe KCl-Badperfusion. (5) Bewertung von Fluoreszenzintensitätsmessungen im Laufe der Zeit, um Calciumtransienten oder synaptische Vesikelfusion zu messen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Drei Schritte, die beiden beschriebenen Methoden gemeinsam sind, sind von entscheidender Bedeutung für den experimentellen Erfolg und quantifizierbare Ergebnisse. Erstens ist die Vorbereitung von frischem aCSF vor jeder Experimentierrunde unter Einhaltung der beigefügten Anweisungen unerlässlich. Andernfalls kann eine angemessene neuronale Depolarisation verhindert werden. Eine Probe unbehandelter Kontrollneuronen sollte vor der Stimulation von Versuchsgruppen ständig getestet werden, um eine ordnungsgemäße zellul?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Wir danken den anwesenden und ehemaligen Mitgliedern des Jefferson Weinberg ALS Center für kritisches Feedback und Anregungen zur Optimierung dieser Techniken und deren Analysen. Diese Arbeit wurde durch Mittel des NIH (RF1-AG057882-01 und R21-NS0103118 bis D.T.), der NINDS (R56-NS092572 und R01-NS109150 bis P.P.), der Muscular Dystrophy Association (D.T.), des Robert Packard Center for ALS Research (D.T.), der Family Strong 4 ALS Foundation und der Farber Family Foundation (B.K.J., K.K, und P.P.) unterstützt.
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
Referências
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neurociência. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

