Непрерывный флуоресцентный анализ метилирования ДНК на основе эндонуклеазы для скрининга ингибиторов ДНК-метилтрансферазы
Summary
ДНК-метилтрансферазы являются потенциальными мишенями лекарств от рака. Здесь представлен протокол для оценки малых молекул ингибирования ДНК-метилтрансферазы. Этот анализ использует эндонуклеазу для соединения метилирования ДНК с генерацией флуоресценции и позволяет контролировать активность ферментов в режиме реального времени.
Abstract
Метилирование ДНК, форма эпигенетической регуляции генов, важно для нормальной клеточной функции. В клетках белки, называемые ДНК-метилтрансферазами (DDNMT), устанавливают и поддерживают паттерн метилирования ДНК. Изменения в нормальном паттерне метилирования ДНК связаны с развитием и прогрессированием рака, что делает DDNMT потенциальными мишенями для лекарств от рака. Таким образом, выявление и характеристика новых низкомолекулярных ингибиторов этих ферментов имеет большое значение. В этой статье представлен протокол, который может быть использован для скрининга ингибиторов ДНК-метилтрансферазы. Непрерывный связанный кинетический анализ позволяет определить начальные скорости метилирования ДНК в присутствии и отсутствии потенциальных ингибиторов малых молекул. Анализ использует метил-чувствительную эндонуклеазу Gla I для соединения метилирования гемиметилированного субстрата ДНК с генерацией флуоресценции.
Этот непрерывный анализ позволяет контролировать активность ферментов в режиме реального времени. Проведение анализа в небольших объемах в микротитрных пластинах снижает стоимость реагентов. Используя этот анализ, был проведен небольшой пример скрининга для ингибиторов DNMT1, наиболее распространенного изофермента DNMT у людей. Высокозамещенный натуральный продукт антрахинона, лаккаевая кислота А, является мощным, конкурентоспособным по ДНК ингибитором DNMT1. Здесь мы исследуем три потенциальных ингибитора малых молекул — антрахиноны или антрахиноподобные молекулы с одним-тремя заместителями — в двух концентрациях, чтобы описать протокол анализа. Начальные скорости используются для расчета процентной активности, наблюдаемой в присутствии каждой молекулы. Одно из трех исследованных соединений демонстрирует концентрационно-зависимое ингибирование активности DNMT1, что указывает на то, что оно является потенциальным ингибитором DNMT1.
Introduction
Метилирование ДНК является важным эпигенетическим маркером, который регулирует экспрессию генов и структуру хроматина. Метилирование происходит преимущественно в cpG динуклеотидах — цитозине, за которым следует гуанозин; метильную группу добавляют к 5-позиции цитозина. Правильные паттерны метилирования ДНК и, следовательно, правильная экспрессия генов необходимы для соответствующего клеточного развития и функционирования. Многие болезненные состояния были связаны с изменениями нормальной картины метилирования 1,2,3. Например, существует связь между инициацией и прогрессированием рака и изменениями в паттерне метилирования ДНК. Как правило, раковые клетки демонстрируют более низкие общие уровни метилцитозина, что способствует нестабильности генома. При этом метилцитозин, присутствующий в геноме, концентрируется в промоторных областях генов-супрессоров опухолей, что приводит к глушению генов этих важных белков. Примечательно, что эпигенетические изменения являются динамичными и обратимыми, в отличие от мутаций ДНК, связанных с опухолевым генезом. Это сделало белки, участвующие в эпигенетической регуляции генов, интересными лекарственными мишенями 2,4.
ДНК-метилтрансферазы (DDNMT) являются белками, ответственными за генерацию и поддержание паттернов метилирования ДНК. Три каталитически активных изофермента, DNMT1, DNMT3a и DNMT3b, существуют у людей. Во время разработки и дифференцировки de novo метилтрансферазы, DNMT3a и DNMT3b, устанавливают паттерны метилирования. Оба фермента могут связывать каталитически неактивный белок DNMT3L с образованием комплексов, которые проявляют повышенную активность 1,5. После деления клеток дочерние клетки содержат гемиметилированную ДНК — ДНК, содержащую метилцитозин только в одной нити дуплекса — потому что вновь синтезированная ДНК лишена меток метилирования. Основная функция DNMT1 заключается в метилировании этой гемиметилированной ДНК, тем самым восстанавливая полную картину метилирования 1,5.
Связи между активностью DNMT и раком хорошо известны. Сверхэкспрессия DNMT1, либо транскрипционными, либо посттрансляционными механизмами, является следствием нескольких общих онкогенных путей 6,7,8,9. Генетические подходы к снижению активности DNMT1 с использованием гипоморфных аллелей приводят к уменьшению образования опухоли у мышей Apc(Min)10. Антисмысловые олигонуклеотиды, которые нокдают DNMT1, ингибируют неоплазию в клеточной культуре и моделях опухолей мышей 11,12. Таким образом, ингибирование активности DNMT1 кажется многообещающим подходом к терапии рака. Однако роли, которые играют изоферменты DNMT3, не так просты. Мутации DNMT3a обнаруживаются при остром миелоидном лейкозе13 и миелодиспластическом синдроме14. Было показано, что по меньшей мере одна из идентифицированных мутаций снижает активность метилирования ДНК фермента15. Тем не менее, DNMT3b чрезмерно экспрессируется при раке молочной железы16 и колоректальном раке17. Поскольку различные изоферменты DNMT играют различную роль в канцерогенезе, идентификация изофермент-специфических ингибиторов будет иметь решающее значение. Мало того, что эти соединения будут полезны для разработки терапевтических средств, но изофермент-специфические ингибиторы также будут бесценным инструментом для анализа роли каждого изофермента DNMT в этиологии рака.
В литературе сообщалось о нескольких ингибиторах DNMT. Известные ингибиторы DNMT можно разделить на два класса: нуклеозидные и ненуклеозидные. Нуклеозидные ингибиторы обычно являются аналогами цитидина. Эти соединения включены в ДНК и ковалентно улавливают DNMTs. 5-азацитидин и 5-аза-2′-дезоксицитидин были одобрены для лечения миелодиспластического синдрома и острого миелоидного лейкоза 4,18. Высокая токсичность, низкая биодоступность и химическая нестабильность этих соединений представляют проблемы. Текущая работа изучает эффективность следующего поколения нуклеозидных ингибиторов; SGI-110, полученный из 5-аза-2′-дезоксицитидина, является одним из примеров19,20. Нуклеозидные ингибиторы не являются изофермент-специфическими и инактивируют любой встречающийся изофермент DNMT. Таким образом, обработка нуклеозид-деметилирующим агентом приводит к истощению всех изоферментов DNMT 4,18. Ненуклеозидные ингибиторы не нужно включать в ДНК, чтобы оказывать их ингибирующее действие. Вместо этого эти молекулы связываются непосредственно с DDNMT, вводя возможность для изофермент-специфического ингибирования. На сегодняшний день было обнаружено несколько ненуклеозидных ингибиторов, включая SGI-102721, гидралазин22, прокаинамид23, RG108 и производные24, а также натуральные продукты, (-)-эпигаллокатехин 3-галлат (EGCG)25 и лаккаевую кислоту A26,27. Большинство ненуклеозидных ингибиторов, обнаруженных на сегодняшний день, не являются изофермент-селективными или демонстрируют слабые предпочтения для одного изофермента DNMT. Кроме того, необходимо улучшить эффективность этих молекул, особенно в клетках 4,18. Таким образом, существует необходимость в открытии или разработке более мощных, изофермент-селективных ингибиторов DNMT.
Препятствием для открытия новых низкомолекулярных ингибиторов DNMT являются трудоемкие анализы, традиционно используемые для изучения активности DNMT28. Анализы обычно прерывистые с несколькими шагами. Ферментативная активность DNMT по-прежнему регулярно анализируется с использованием радиоактивного S-аденозилметионина (SAM)29,30,31,32,33,34. Также были разработаны нерадиоактивные анализы метилирования ДНК. Например, описаны анализы с использованием метилчувствительных эндонуклеаз рестрикции и электрофореза для разделения продуктов пищеварения35,36. Эти типы прерывистых, многоступенчатых анализов не поддаются открытию лекарств. С середины 2000-х годов было разработано несколько анализов метилирования ДНК с более высокой пропускной способностью28. Сцинтилляционный бесконтактный анализ использовался для скрининга ингибиторов DNMT137. Другой анализ с использованием метил-чувствительной рестрикционной эндонуклеазы был использован для скрининга ингибиторов DNMT3a25,38. Хотя оба анализа позволили получить более высокую пропускную способность, чем традиционные анализы метилирования ДНК, анализы требуют нескольких этапов и не позволяют наблюдать активность метилирования в режиме реального времени. Совсем недавно был описан непрерывный кинетический анализ, который связывает образование S-аденозилгомоцистеина (SAH), одного из продуктов реакции метилирования, со спектроскопическим изменением при 340 нм, связанным с окислением NADPH39. Этот анализ использует три фермента связи для генерации спектроскопического сигнала.
Мы разработали анализ метилирования ДНК на основе флуоресценции, связанный с эндонуклеазой, который использует один коммерчески доступный фермент связи и может генерировать данные в режиме реального времени (рисунок 1). В качестве субстрата используется олигонуклеотид шпильки, содержащий три метилцитозина. СУБСТРАТНАЯ ДНК содержит флуорофор на 5′ конце и гаситель на 3′ конце. Метилирование гемиметилированного сайта CpG генерирует участок расщепления для эндонуклеазы Gla I — полностью метилированного GCGC. Расщепление продукта олигонуклеотид gla I высвобождает флуорофор из гасителя и генерирует флуоресценцию в режиме реального времени. Анализ может быть использован для изучения активности любой изоформы DNMT; однако более высокая активность наблюдается при DNMT1, так как этот изофермент преимущественно метилирует гемиметилированную ДНК 1,5. Еще более устойчивая активность наблюдается, если домен автоингибаторной последовательности таргетирования фокусов репликации (RFTS) удаляется из DNMT1. Этот домен, обнаруженный в N-концевой регуляторной области, связывается с каталитическим сайтом и предотвращает связывание ДНК. Удаление первых ~ 600 аминокислот приводит к усеченному ферменту, который значительно более активен, чем фермент полной длины (~ 640-кратное увеличение kcat/Km)40. Эта активированная форма фермента, называемая RFTS-отсутствующим DNMT1 (аминокислоты 621–1616), позволяет легче идентифицировать ингибиторы из-за его повышенной каталитической мощности. В этой статье представлен протокол для использования RFTS-отсутствующего DNMT1 в анализах для скрининга потенциальных ингибиторов малых молекул. С помощью непрерывного анализа, связанного с эндонуклеазой, начальную скорость определяют в присутствии и отсутствии нескольких малых молекул. Каждый потенциальный ингибитор исследуется в двух концентрациях для поиска концентрационно-зависимого ингибирования DNMT1. Процент активности, наблюдаемый в присутствии малых молекул, был рассчитан в каждом случае.
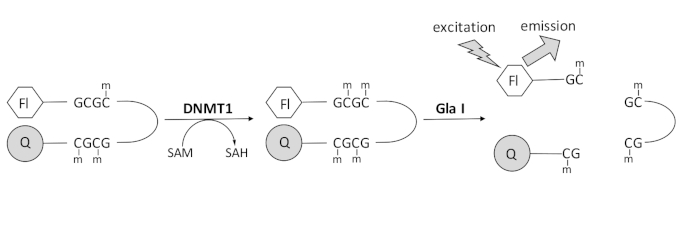
Рисунок 1: Анализ метилирования ДНК. В качестве субстрата используется гемиметилированная шпилька ДНК с флуорофором на 5′ конце и гасителем на 3′ конце. DNMT1 катализирует перенос метильной группы из S-аденозилметионина в неметилированный сайт CpG, генерируя S-аденозилгомоцистеин и полностью метилированную ДНК. Продукт ДНК содержит участок расщепления эндонуклеазы Gla I, которая расщепляет полностью метилированные участки GCGC. Расщепление ДНК продукта высвобождает 5′ флуорофор из 3′ гасителя, генерируя флуоресценцию. Сокращения: Fl = флуорофор; Q = quencher; DNMT1 = ДНК-метилтрансфераза 1; SAM = S-аденозилметионин; SAH = S-аденозилгомоцистеин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Для выявления и характеристики ингибиторов ДНК-метилтрансфераз необходимо измерить активность фермента. Существует несколько методов изучения активности ДНК-метилтрансферазы. Активность обычно контролируется с помощью радиоактивности; перенос меченой метильной группы SAM может быт…
Declarações
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят Университет Бакнелла и химический факультет за поддержку этой работы.
Materials
| 96-well Half Area Black Flat Bottom Polystyrene Not Treated Microplate | Corning | 3694 | |
| 96-Well Polystyrene Conical Bottom Plates | ThermoFisher | 249570 | |
| Bovine Serum Albumin | NEB | B9000S | |
| compound 1 | ChemBridge | 5812086 | screening compound; resuspended in DMSO to 10 mM |
| compound 2 | ChemBridge | 6722175 | screening compound; resuspended in DMSO to 10 mM |
| compound 3 | ChemBridge | 5249376 | screening compound; resuspended in DMSO to 10 mM |
| Dithiothreitol | Sigma | D0632 | |
| Gla I | SibEnzyme | E494 | methyl-sensitive endonuclease |
| Glycerol | RPI | G22025 | |
| Magnesium Chloride | Sigma | M0250 | |
| Oligonucleotide (5'-FAM-CCTATGCGmCATCAGTTTTCTGATGmCGmCATAGG-3'-Iowa Black Quencher) | IDT | custom synthesized | internally quenched hairpin DNA (substrate) |
| Potassium Glutamate | Sigma | G1501 | |
| S-adenosylmethionine | Sigma | A4377 | methyl-donating co-factor (substrate) |
| Tris Base | RPI | T60040 |
Referências
- Jurkowska, R. Z., Jurkowski, T. P., Jeltsch, A. Structure and function of mammalian DNA methyltransferases. Chembiochem. 12 (2), 206-222 (2011).
- Hamidi, T., Singh, A. K., Chen, T. Genetic alterations of DNA methylation machinery in human diseases. Epigenomics. 7 (2), 247-265 (2015).
- Norvil, A. B., Saha, D., Dar, M. S., Gowher, H. Effect of disease-associated germline mutations on structure function relationship of DNA methyltransferases. Genes. 10 (5), 369 (2019).
- Foulks, J. M., et al. Epigenetic drug discovery: targeting DNA methyltransferases. Journal of Biomolecular Screening. 17 (1), 2-17 (2012).
- Goll, M. G., Bestor, T. H. Eukaryotic cytosine methyltransferases. Annual Review of Biochemistry. 74, 481-514 (2005).
- Bigey, P., Ramchandani, S., Theberge, J., Araujo, F. D., Szyf, M. Transcriptional regulation of the human DNA Methyltransferase (dnmt1) gene. Gene. 242 (1-2), 407-418 (2000).
- Detich, N., Ramchandani, S., Szyf, M. A conserved 3′-untranslated element mediates growth regulation of DNA methyltransferase 1 and inhibits its transforming activity. Journal of Biological Chemistry. 276 (27), 24881-24890 (2001).
- MacLeod, A. R., Rouleau, J., Szyf, M. Regulation of DNA methylation by the Ras signaling pathway. Journal of Biological Chemistry. 270 (19), 11327-11337 (1995).
- Slack, A., Cervoni, N., Pinard, M., Szyf, M. DNA methyltransferase is a downstream effector of cellular transformation triggered by simian virus 40 large T antigen. Journal of Biological Chemistry. 274 (15), 10105-10112 (1999).
- Eads, C. A., Nickel, A. E., Laird, P. W. Complete genetic suppression of polyp formation and reduction of CpG-island hypermethylation in Apc(Min/+) Dnmt1-hypomorphic mice. Pesquisa do Câncer. 62, 1296-1299 (2002).
- MacLeod, A. R., Szyf, M. Expression of antisense to DNA methyltransferase mRNA induces DNA demethylation and inhibits tumorigenesis. Journal of Biological Chemistry. 270 (14), 8037-8043 (1995).
- Ramchandani, S., MacLeod, A. R., Pinard, M., von Hofe, E., Szyf, M. Inhibition of tumorigenesis by a cytosine-DNA, methyltransferase, antisense oligodeoxynucleotide. Proceedings of the National Academy Sciences of the United States of America. 94 (2), 684-689 (1997).
- Ley, T. J., et al. DNMT3A mutations in acute myeloid leukemia. New England Journal of Medicine. 363, 2424-2433 (2010).
- Walter, M. J., et al. Recurrent DNMT3A mutations in patients with myelodysplastic syndromes. Leukemia. 25 (7), 1153-1158 (2011).
- Russler-Germain, D. A., et al. The R882H DNMT3A mutation associated with AML dominantly inhibits wild-type DNMT3A by blocking its ability to form active tetramers. Cancer Cell. 25 (4), 442-454 (2014).
- Roll, J. D., Rivenbark, A. G., Jones, W. D., Coleman, W. B. DNMT3b overexpression contributes to a hypermethylator phenotype in human breast cancer cell lines. Molecular Cancer. 7, 15 (2008).
- Nosho, K., et al. DNMT3B expression might contribute to CpG island methylator phenotype in colorectal cancer. Clinical Cancer Research. 15 (11), 3663-3671 (2009).
- Erdmann, A., Halby, L., Fahy, J., Arimondo, P. B. Targeting DNA methylation with small molecules: what’s next. Journal of Medicinal Chemistry. 58 (6), 2569-2583 (2015).
- Chuang, J. C., et al. S110, a 5-Aza-2′-deoxycytidine-containing dinucleotide, is an effective DNA methylation inhibitor in vivo and can reduce tumor growth. Molecular Cancer Therapeutics. 9 (5), 1443-1450 (2010).
- Issa, J. J., et al. Safety and tolerability of guadecitabine (SGI-110) in patients with myelodysplastic syndrome and acute myeloid leukaemia: a multicentre, randomised, dose-escalation phase 1 study. Lancet Oncology. 16 (9), 1099-1110 (2015).
- Datta, J., et al. A new class of quinoline-based DNA hypomethylating agents reactivates tumor suppressor genes by blocking DNA methyltransferase 1 activity and inducing its degradation. Pesquisa do Câncer. 69 (10), 4277-4285 (2009).
- Zambrano, P., et al. A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor genes. BMC Cancer. 5, 44 (2005).
- Lee, B. H., Yegnasubramanian, S., Lin, X., Nelson, W. G. Procainamide is a specific inhibitor of DNA methyltransferase 1. Journal of Biological Chemistry. 280 (49), 40749-40756 (2005).
- Asgatay, S., et al. Synthesis and evaluation of analogues of N-phthaloyl-l-tryptophan (RG108) as inhibitors of DNA methyltransferase 1. Journal of Medicinal Chemstry. 57 (2), 421-434 (2014).
- Ceccaldi, A., et al. C5-DNA methyltransferase inhibitors: from screening to effects on zebrafish embryo development. Chembiochem. 12 (9), 1337-1345 (2011).
- Fagan, R. L., Wu, M., Chédin, F., Brenner, C. An ultrasensitive high throughput screen for DNA methyltransferase 1-targeted molecular probes. PLoS One. 8 (11), 78752 (2013).
- Fagan, R. L., Cryderman, D. E., Kopelovich, L., Wallrath, L. L., Brenner, C. Laccaic acid A is a direct, DNA-competitive inhibitor of DNA methyltransferase 1. Journal of Biological Chemistry. 288 (33), 23858-23867 (2013).
- Eglen, R. M., Reisine, T. Screening for compounds that modulate epigenetic regulation of the transcriptome: an overview. Journal of Biomolecular Screening. 16 (10), 1137-1152 (2011).
- Holz-Schietinger, C., Matje, D. M., Reich, N. O. Mutations in DNA methyltransferase (DNMT3A) observed in acute myeloid leukemia patients disrupt processive methylation. Journal of Biological Chemistry. 287 (37), 30941-30951 (2012).
- Norvil, A. B., et al. Dnmt3b methylates DNA by a noncooperative mechanism, and its activity is unaffected by manipulations at the predicted dimer interface. Bioquímica. 57 (29), 4312-4324 (2018).
- Bashtrykov, P., Ragozin, S., Jeltsch, A. Mechanistic details of the DNA recognition by the Dnmt1 DNA methyltransferase. FEBS Letters. 586 (13), 1821-1823 (2012).
- Bashtrykov, P., et al. Targeted mutagenesis results in an activation of DNA methyltransferase 1 and confirms an autoinhibitory role of its RFTS domain. Chembiochem. 15 (5), 743-748 (2014).
- Berkyurek, A. C., et al. The DNA methyltransferase Dnmt1 directly interacts with the SET and RING finger-associated (SRA) domain of the multifunctional protein Uhrf1 to facilitate accession of the catalytic center to hemi-methylated DNA. Journal of Biological Chemistry. 289 (1), 379-386 (2014).
- Kanada, K., Takeshita, K., Suetake, I., Tajima, S., Nakagawa, A. Conserved threonine 1505 in the catalytic domain stabilizes mouse DNA methyltransferase 1. Journal of Biochemistry. 162 (4), 271-278 (2017).
- Bashtrykov, P., et al. Specificity of Dnmt1 for methylation of hemimethylated CpG sites resides in its catalytic domain. Chemistry & Biology. 19 (5), 572-578 (2012).
- Dolen, E. K., McGinnis, J. H., Tavory, R. N., Weiss, J. A., Switzer, R. L. Disease-associated mutations G589A and V590F relieve replication focus targeting sequence-mediated autoinhibition of DNA methyltransferase 1. Bioquímica. 58 (51), 5151-5159 (2019).
- Kilgore, J. A., et al. Identification of DNMT1 selective antagonists using a novel scintillation proximity assay. Journal of Biological Chemistry. 288 (27), 19673-19684 (2013).
- Ceccaldi, A., et al. Identification of novel inhibitors of DNA methylation by screening of a chemical library. ACS Chemical Biology. 8 (3), 543-548 (2013).
- Duchin, S., Vershinin, Z., Levy, D., Aharoni, A. A continuous kinetic assay for protein and DNA methyltransferase enzymatic activities. Epigenetics & Chromatin. 8, 56 (2015).
- Syeda, F., et al. The replication focus targeting sequence (RFTS) domain is a DNA-competitive inhibitor of Dnmt1. Journal of Biological Chemistry. 286 (17), 15344-15351 (2011).
- Switzer, R. L., Medrano, J., Reedel, D. A., Weiss, J. Substituted anthraquinones represent a potential scaffold for DNA methyltransferase 1-specific inhibitors. PLoS One. 14 (7), 0219830 (2019).

