Fermentations contrôlées par la lumière pour la production de produits chimiques microbiens et de protéines
Summary
Le contrôle optogénétique du métabolisme microbien offre un contrôle dynamique flexible des processus de fermentation. Le protocole montre ici comment mettre en place des fermentations régulées par la lumière bleue pour la production de produits chimiques et de protéines à différentes échelles volumétriques.
Abstract
Les usines de cellules microbiennes offrent une alternative durable pour la production de produits chimiques et de protéines recombinantes à partir de matières premières renouvelables. Cependant, surcharger un micro-organisme avec des modifications génétiques peut réduire la condition physique et la productivité de l’hôte. Ce problème peut être surmonté en utilisant un contrôle dynamique: expression inductible des enzymes et des voies, généralement à l’aide d’additifs chimiques ou nutritifs, pour équilibrer la croissance et la production cellulaires. L’optogénétique offre une méthode non invasive, hautement accordable et réversible de régulation dynamique de l’expression des gènes. Ici, nous décrivons comment mettre en place des fermentations contrôlées par la lumière d’Escherichia coli et de Saccharomyces cerevisiae pour la production de produits chimiques ou de protéines recombinantes. Nous discutons de la façon d’appliquer la lumière à des moments et des dosages sélectionnés pour découpler la croissance et la production microbiennes afin d’améliorer le contrôle de la fermentation et la productivité, ainsi que des principales considérations d’optimisation pour de meilleurs résultats. De plus, nous décrivons comment mettre en œuvre des contrôles de lumière pour des expériences de bioréacteur à l’échelle du laboratoire. Ces protocoles facilitent l’adoption de contrôles optogénétiques dans les micro-organismes modifiés pour améliorer les performances de fermentation.
Introduction
L’optogénétique, le contrôle des processus biologiques avec des protéines sensibles à la lumière, offre une nouvelle stratégie pour contrôler dynamiquement les fermentations microbiennes pour la production chimique et protéique1,2. Le fardeau des voies métaboliques modifiées et la toxicité de certains intermédiaires et produits nuisent souvent à la croissance cellulaire3. De tels stress peuvent entraîner une mauvaise accumulation de biomasse et une productivité réduite3. Ce défi peut être relevé en divisant temporellement les fermentations en une phase de croissance et de production, qui consacrent des ressources métaboliques à l’accumulation de biomasse ou à la synthèse de produits respectivement4. Nous avons récemment montré que la transition de la croissance à la production dans cette fermentation en deux phases peut être induite par des changements dans les conditions d’éclairage5,6,7. La haute accordabilité, la réversibilité et l’orthogonalité des apports lumineux8 offrent des avantages uniques aux fermentations contrôlées par la lumière qui sont difficiles ou impossibles à reproduire avec des inducteurs chimiques utilisés dans le contrôle dynamique des fermentations biphasées conventionnelles4,9,10,11.
La protéine EL222 sensible à la lumière bleue dérivée d’Erythrobacter litoralis a été utilisée pour développer plusieurs circuits optogénétiques pour l’ingénierie métabolique chez Saccharomyces cerevisiae5,7,12,13. EL222 contient un domaine de capteur lumière-oxygène-tension (LOV) qui subit un décalage conformationnel lors de l’activation de la lumière bleue (465 nm), ce qui lui permet de se lier à sa séquence d’ADN apparenté (C120)13. La fusion d’EL222 au domaine d’activation viral VP16 (VP16-EL222) donne un facteur de transcription sensible à la lumière bleue qui peut activer de manière réversible l’expression génique chez S. cerevisiae7 et d’autres organismes14 à partir du promoteur synthétique PC120. Plusieurs circuits basés sur EL222 ont été développés et utilisés pour la production chimique chez S. cerevisiae, tels que le système OptoEXP de base activé par la lumière7, dans lequel le gène d’intérêt est directement exprimé à partir de PC120 (Figure 1A). Cependant, les préoccupations de pénétration de la lumière aux densités cellulaires élevées généralement rencontrées dans la phase de production des fermentations nous ont motivés à développer des circuits inversés induits dans l’obscurité, tels que les circuits OptoINVRT et OptoQ-INVRT (Figure 1B)5,7,13. Ces systèmes exploitent les régulons de galactose (GAL) ou d’acide quinique (Q) de S. cerevisiae et N. crassa, respectivement, contrôlant leurs répresseurs correspondants (GAL80 et QS) avec VP16-EL222, pour réprimer l’expression des gènes dans la lumière et l’induire fortement dans l’obscurité. La combinaison des circuits OptoEXP et OptoINVRT permet un contrôle bidirectionnel de l’expression des gènes, permettant des fermentations en deux phases dans lesquelles la phase de croissance est induite par la lumière bleue et la phase de production par l’obscurité (Figure 2A)5,7.
L’utilisation de la lumière au lieu de l’obscurité pour induire l’expression des gènes pendant la phase de production élargirait considérablement les capacités des contrôles optogénétiques, mais nécessiterait également de surmonter les limites de pénétration de la lumière des densités cellulaires élevées généralement rencontrées dans cette phase de fermentation. À cette fin, nous avons développé des circuits, connus sous le nom d’OptoAMP et OptoQ-AMP, qui amplifient la réponse transcriptionnelle à la stimulation par la lumière bleue. Ces circuits utilisent des mutants de type sauvage ou hypersensibles de VP16-EL222 pour contrôler la production des activateurs transcriptionnels Gal4p ou QF2 des régulons GAL ou Q, respectivement, obtenant une sensibilité accrue et une expression génique plus forte avec la lumière12,13 (Figure 1C). Les circuits OptoAMP peuvent obtenir une induction lumineuse complète et homogène dans des bioréacteurs de 5 L à une densité optique (mesurée à 600 nm; OD600) valeurs d’au moins 40 avec seulement ~ 0,35% d’éclairage (dose de lumière de 5% sur seulement ~ 7% de la surface en vrac). Cela démontre un degré de sensibilité plus élevé par rapport à OptoEXP, qui nécessite un éclairage proche de 100 %12. La capacité d’induire efficacement l’expression des gènes avec de la lumière à des densités cellulaires élevées ouvre de nouvelles possibilités de contrôle dynamique des fermentations. Cela inclut l’exploitation de fermentations dans plus de deux phases temporelles, telles que les fermentations triphasées, dans lesquelles les phases de croissance, d’induction et de production sont établies avec des calendriers d’éclairage uniques pour optimiser la production chimique (Figure 2B)12.
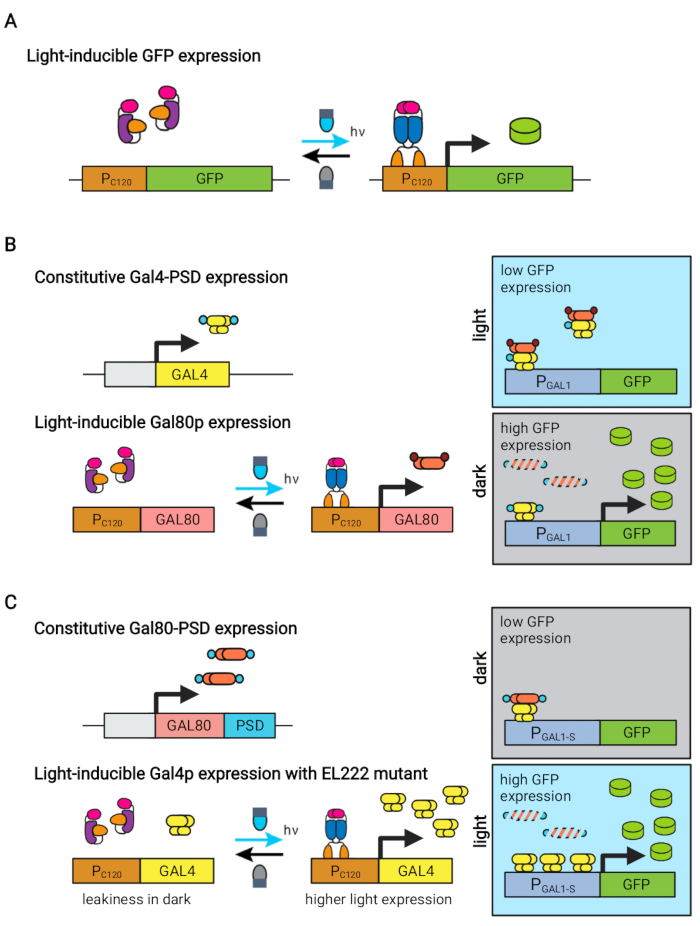
Figure 1 : Circuits optogénétiques pour le contrôle dynamique de S. cerevisiae. Les circuits OptoEXP, OptoINVRT et OptoAMP sont basés sur le système sensible à la lumière VP16-EL222. (A) Dans le circuit OptoEXP, l’exposition à la lumière bleue provoque un changement conformationnel et une dimérisation de VP16-EL222, ce qui expose un domaine de liaison à l’ADN et permet la transcription à partir de PC120. La figure a été modifiée à partir de Zhao et al.7. (B) Les circuits OptoINVRT exploitent les régulons GAL (illustrés) ou Q pour induire une expression dans l’obscurité. Dans les circuits à base de GAL, VP16-EL222 et GAL4 sont exprimés de manière constitutive, tandis que le PC120 entraîne l’expression du répresseur GAL80 (dans les circuits à base de Q, GAL4 et GAL80 sont remplacés par QF2 et QS, respectivement, et un promoteur synthétique contenant DU QUAS est utilisé à la place d’un promoteur GAL). À la lumière, Gal80p empêche l’activation du gène d’intérêt de PGAL1. Dans l’obscurité, GAL80 n’est pas exprimé et se dégrade rapidement en le fusionnant en un domaine degron constitutif (petit domaine brun), ce qui permet l’activation de PGAL1 par Gal4p. La figure a été modifiée à partir de Zhao et al.5. (C) Les circuits OptoAMP utilisent également VP16-EL222 pour contrôler les régulons GAL (illustrés) ou Q. Dans ces circuits, le répresseur GAL80 (ou QS) est exprimé de manière constitutive et fusionné à un degron photosensible (petit domaine bleu) assurant une répression stricte dans l’obscurité. PC120 et un mutant hypersensible VP16-EL222 contrôlent l’expression de GAL4 (ou QF2) avec la lumière, ce qui active fortement PGAL1 (ou un promoteur contenant QUAS) dans la lumière. Les circuits dérivés de GAL peuvent utiliser des formes techniques de PGAL1, telles que PGAL1-M ou PGAL1-S, qui ont une activité accrue, ainsi que des promoteurs de type sauvage contrôlés par le régulateur GAL (PGAL1, PGAL10, PGAL2, PGAL7). La figure a été modifiée à partir de Zhao et al.12. Veuillez cliquer ici pour voir une version plus grande de cette figure.
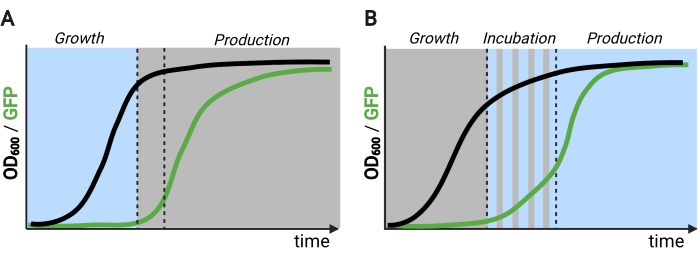
Figure 2: Fermentations biphasées et triphasées dans le temps. (A) Les fermentations biphasées opérées avec des circuits inversés se composent d’une phase de croissance entraînée par la lumière et d’une phase de production sombre. Dans la phase de croissance, la biomasse s’accumule à mesure que la voie de production reste réprimée. Lorsqu’elles atteignent l’OD600 souhaitée, les cellules sont déplacées vers l’obscurité pour s’ajuster métaboliquement avant d’être remises en suspension dans des milieux frais pour la phase de production. (B) Dans un processus en trois phases, les phases de croissance, d’incubation et de production sont définies par des horaires lumineux uniques, qui peuvent consister en une période de croissance sombre, une incubation pulsée et une phase de production entièrement éclairée. Figure créée avec Biorender. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Des circuits optogénétiques ont également été développés pour le contrôle dynamique de la production chimique et protéique chez E. coli. Les circuits OptoLAC contrôlent le répresseur LacI bactérien à l’aide du circuit pDawn sensible à la lumière, basé sur le système à deux composants YF1/FixJ6 (Figure 3). Semblables à OptoINVRT5, les circuits OptoLAC sont conçus pour réprimer l’expression des gènes dans la lumière et l’induire dans l’obscurité. Les niveaux d’expression utilisant les circuits OptoLAC peuvent égaler ou dépasser ceux atteints avec l’induction standard de l’isopropyle β-d-1-thiogalactopyranoside (IPTG), maintenant ainsi la force de l’induction chimique tout en offrant une accordabilité et une réversibilité améliorées6. Par conséquent, les circuits OptoLAC permettent un contrôle optogénétique efficace pour l’ingénierie métabolique chez E. coli.
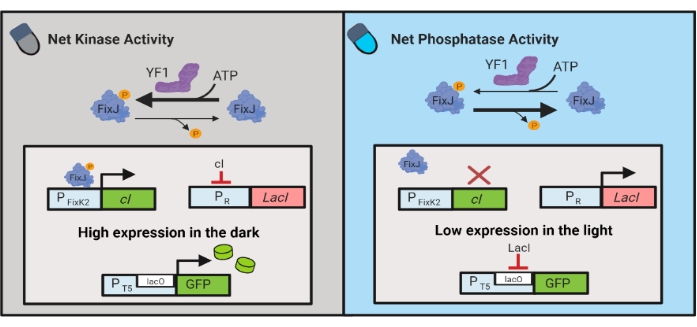
Figure 3 : Circuits OptoLAC pour le contrôle dynamique d’E. coli. Les circuits OptoLAC adaptent le système pDawn et l’opéron lac pour réaliser l’activation dans l’obscurité et la répression dans la lumière. Dans l’obscurité, YF1 phosphoryle FixJ, qui active ensuite le promoteur PFixK2 pour exprimer le répresseur cI. Le répresseur cI empêche l’expression du répresseur lacI à partir du promoteur PR, ce qui permet la transcription du gène d’intérêt à partir d’un promoteur contenant du lacO. Inversement, la lumière bleue réduit l’activité de la kinase nette YF1, inversant la phosphorylation fixJ et donc l’expression cI, ce qui déprime l’expression de lacI et empêche l’expression du promoteur contenant du lacO. La figure a été modifiée à partir de Lalwani et al.6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous décrivons ici les protocoles de base pour les fermentations contrôlées par la lumière de S. cerevisiae et E. coli pour la production chimique ou protéique. Pour les levures et les bactéries, nous nous concentrons d’abord sur les fermentations avec une phase de croissance entraînée par la lumière et une phase de production induite par l’obscurité rendue possible par les circuits OptoINVRT et OptoLAC. Par la suite, nous décrivons un protocole pour une fermentation triphasée (croissance, induction, production) contrôlée par la lumière rendue possible par les circuits OptoAMP. En outre, nous décrivons comment étendre les fermentations contrôlées optogénétiquement des microplaques aux bioréacteurs à l’échelle du laboratoire. Avec ce protocole, nous visons à fournir un guide complet et facilement reproductible pour effectuer des fermentations contrôlées par la lumière pour la production de produits chimiques ou de protéines.
Protocol
Representative Results
Discussion
Le contrôle dynamique est appliqué depuis longtemps pour améliorer les rendements pour l’ingénierie métabolique et la production de protéines recombinantes4. Les changements dans l’expression enzymatique sont le plus souvent mis en œuvre à l’aide d’inducteurs chimiques tels que IPTG21, galactose22 et tétracycline23, mais ont également été médiés en utilisant des conditions de processus telles que la temp?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été soutenue par le département de l’Énergie des États-Unis, l’Office of Science, le numéro de prix DE-SC0019363 du bureau de la recherche biologique et environnementale, le prix NSF CAREER Award CBET-1751840, The Pew Charitable Trusts et le prix Camille Dreyfus Teacher-Scholar.
Materials
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Referências
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengenharia. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).

