Контролируемые светом ферментации для производства микробных химических веществ и белков
Summary
Оптогенетический контроль микробного метаболизма обеспечивает гибкое динамическое управление процессами ферментации. Протокол здесь показывает, как настроить ферментации, регулируемые синим светом, для химического и белкового производства в разных объемных масштабах.
Abstract
Заводы по производству микробных клеток предлагают устойчивую альтернативу для производства химических веществ и рекомбинантных белков из возобновляемого сырья. Однако перегрузка микроорганизма генетическими модификациями может снизить приспособленность и продуктивность хозяина. Эта проблема может быть преодолена с помощью динамического контроля: индуцируемой экспрессии ферментов и путей, обычно с использованием химических или питательных добавок, чтобы сбалансировать клеточный рост и производство. Оптогенетика предлагает неинвазивный, легко настраиваемый и обратимый метод динамической регуляции экспрессии генов. Здесь мы описываем, как настроить контролируемые светом ферментации инженерных Escherichia coli и Saccharomyces cerevisiae для производства химических веществ или рекомбинантных белков. Мы обсуждаем, как применять свет в выбранное время и дозировки для разъединения роста и производства микробов для улучшения контроля ферментации и производительности, а также ключевые соображения оптимизации для достижения наилучших результатов. Кроме того, мы описываем, как реализовать элементы управления светом для лабораторных экспериментов с биореакторами. Эти протоколы облегчают внедрение оптогенетического контроля в инженерных микроорганизмах для улучшения производительности ферментации.
Introduction
Оптогенетика, контроль биологических процессов с помощью светочувствительных белков, предлагает новую стратегию динамического контроля микробных ферментаций для химического и белкового производства1,2. Бремя инженерных метаболических путей и токсичность некоторых промежуточных продуктов и продуктов часто ухудшают рост клеток3. Такие стрессы могут привести к плохому накоплению биомассы и снижению производительности3. Эта проблема может быть решена путем временного разделения ферментаций на фазу роста и производства, которые выделяют метаболические ресурсы для накопления биомассы или синтеза продукта соответственно4. Недавно мы показали, что переход от роста к производству в этой двухфазной ферментации может быть вызван изменением условий освещения5,6,7. Высокая настраиваемость, обратимость и ортогональность световых входов8 обеспечивают уникальные преимущества для контролируемых светом ферментаций, которые трудно или невозможно воспроизвести с помощью химических индукторов, используемых в динамическом управлении обычными двухфазными ферментациями4,9,10,11.
Чувствительный к синему свету белок EL222, полученный из Erythrobacter litoralis, был использован для разработки нескольких оптогенетических схем для метаболической инженерии в Saccharomyces cerevisiae5,7,12,13. EL222 содержит домен датчика напряжения света и кислорода (LOV), который претерпевает конформационный сдвиг при активации синего света (465 нм), что позволяет ему связываться с его родственной последовательностью ДНК (C120)13. Слияние EL222 с вирусным доменом активации VP16 (VP16-EL222) приводит к созданию фактора транскрипции, реагирующего на синий свет, который может обратимо активировать экспрессию генов у S. cerevisiae7 и других организмов14 из синтетического промотора PC120. Несколько схем на основе EL222 были разработаны и использованы для химического производства в S. cerevisiae, такие как базовая светоактивированная система OptoEXP7, в которой интересующий ген непосредственно экспрессируется из PC120 (рисунок 1A). Тем не менее, опасения по поводу проникновения света при высокой плотности клеток, обычно встречающиеся на производственной фазе ферментаций, побудили нас разработать перевернутые цепи, которые индуцируются в темноте, такие как схемы OptoINVRT и OptoQ-INVRT (рисунок 1B) 5,7,13. Эти системы используют регулоны галактозы (GAL) или хиновой кислоты (Q) из S. cerevisiae и N. crassa соответственно, контролируя их соответствующие репрессоры (GAL80 и QS) с помощью VP16-EL222, чтобы подавить экспрессию генов на свету и сильно индуцировать ее в темноте. Объединение схем OptoEXP и OptoINVRT приводит к двунаправленному контролю экспрессии генов, что позволяет проводить двухфазные ферментации, в которых фаза роста индуцируется синим светом, а фаза производства — темнотой (рисунок 2A)5,7.
Использование света вместо темноты для индуцирования экспрессии генов во время фазы производства значительно расширит возможности оптогенетического контроля, но также потребует преодоления ограничений проникновения света из-за высокой плотности клеток, обычно встречающихся в этой фазе ферментации. С этой целью мы разработали схемы, известные как OptoAMP и OptoQ-AMP, которые усиливают транскрипционный ответ на стимуляцию синего света. Эти схемы используют дикие или гиперчувствительные мутанты VP16-EL222 для контроля производства транскрипционных активаторов Gal4p или QF2 регулонов GAL или Q соответственно, достигая повышенной чувствительности и более сильной экспрессии генов с помощью light12,13 (рисунок 1C). Контуры OptoAMP могут достигать полной и однородной световой индукции в 5 л биореакторах при оптической плотности (измеренной при 600 нм; OD600) значения не менее 40 при освещении всего ~0,35% (5% дозы света только на ~7% объемной поверхности). Это демонстрирует более высокую степень чувствительности по сравнению с OptoEXP, который требует почти 100% освещения12. Способность эффективно индуцировать экспрессию генов светом при высокой плотности клеток открывает новые возможности для динамического контроля ферментаций. Это включает в себя рабочие ферментации в более чем двух временных фазах, таких как трехфазные ферментации, в которых фазы роста, индукции и производства устанавливаются с уникальными световыми графиками для оптимизации химического производства (рисунок 2B)12.
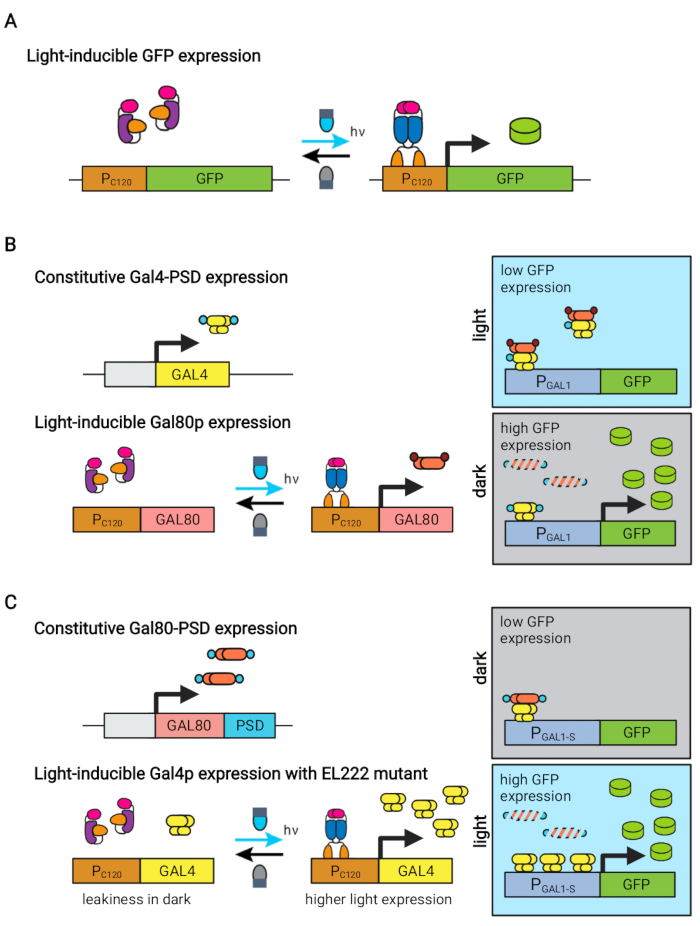
Рисунок 1: Оптогенетические схемы динамического управления S. cerevisiae. Схемы OptoEXP, OptoINVRT и OptoAMP основаны на светочувствительной системе VP16-EL222. (A) В цепи OptoEXP воздействие синего света вызывает конформационное изменение и димеризацию VP16-EL222, что обнажает ДНК-связывающий домен и позволяет транскрипцию из PC120. Рисунок был изменен по сравнению с Zhao et al.7. (B) Контуры OptoINVRT используют GAL (показаны) или Q регулоны для индуцирования экспрессии в темноте. В схемах на основе GAL ПОСЛЕДОВАТЕЛЬНО выражены VP16-EL222 и GAL4 , в то время как PC120 управляет экспрессией репрессора GAL80 (в схемах на основе Q GAL4 и GAL80 заменяются QF2 и QS соответственно, а вместо промотора GAL используется синтетический ПРОМОТОР, содержащий QUAS). В свете Gal80p предотвращает активацию интересующего гена из PGAL1. В темноте GAL80 не выражается и быстро деградирует путем слияния его с конститутивным дегронным доменом (малый коричневый домен), что позволяет активировать PGAL1 Gal4p. Рисунок был изменен по сравнению с Чжао и др.5. (C) Схемы OptoAMP также используют VP16-EL222 для управления GAL (показаны) или Q-регулонами. В этих схемах репрессор GAL80 (или QS) конститутивно выражен и слит с фоточувствительным дегроном (малый синий домен), обеспечивающим жесткое подавление в темноте. PC120 и гиперчувствительная VP16-EL222 мутантная контрольная экспрессия GAL4 (или QF2) со светом, который сильно активирует PGAL1 (или QUAS-содержащий промотор) в свете. Схемы, полученные из GAL, могут использовать инженерные формы PGAL1, такие как PGAL1-M или PGAL1-S, которые имеют повышенную активность, а также промоторы дикого типа, контролируемые регулятором GAL (PGAL1, PGAL10, PGAL2, PGAL7). Рисунок был изменен из Zhao et al.12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
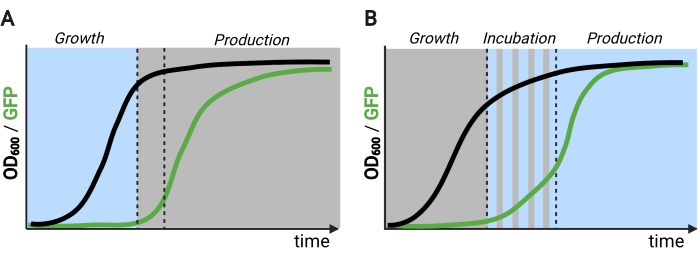
Рисунок 2: Двух- и трехфазные ферментации во времени. (А) Двухфазные ферментации, работающие с перевернутыми контурами, состоят из фазы роста, управляемой светом, и темной фазы производства. В фазе роста биомасса накапливается по мере того, как производственный путь остается подавленным. По достижении желаемого OD600 клетки смещаются в темноту для метаболической корректировки, прежде чем быть повторно суспендированными в свежих средах для фазы производства. (B) В трехфазном процессе фазы роста, инкубации и производства определяются уникальными световыми графиками, которые могут состоять из темного периода роста, импульсной инкубации и полностью освещенной фазы производства. Рисунок, созданный с помощью Biorender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Также были разработаны оптогенетические схемы для динамического контроля химического и белкового производства в кишечной палочке. Схемы OptoLAC управляют бактериальным репрессором LacI с помощью светочувствительной схемы pDawn, которая основана на двухкомпонентной системе YF1/FixJ6 (рисунок 3). Подобно OptoINVRT5, схемы OptoLAC предназначены для подавления экспрессии генов на свету и индуцирования ее в темноте. Уровни экспрессии с использованием схем OptoLAC могут совпадать или превышать уровни, достигнутые при стандартной индукции изопропил-β-d-1-тиогалактопиранозида (IPTG), тем самым сохраняя силу химической индукции, обеспечивая при этом повышенную настраиваемость и обратимость6. Таким образом, схемы OptoLAC обеспечивают эффективный оптогенетический контроль метаболической инженерии в E. coli.
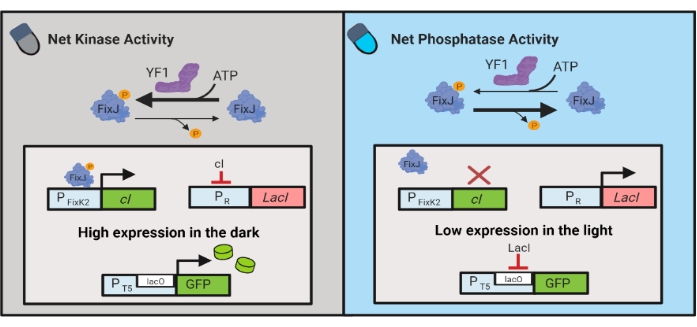
Рисунок 3: Схемы OptoLAC для динамического управления кишечной палочкой. Схемы OptoLAC адаптируют систему pDawn и lac operon для достижения активации в темноте и подавления на свету. В темноте YF1 фосфорилирует FixJ, который затем активирует промотор PFixK2 для экспрессии cI-репрессора . CI-репрессор предотвращает экспрессию репрессора lacI от промотора PR , что позволяет транскрипцию интересующего гена от lacO-содержащего промотора. И наоборот, синий свет снижает активность чистой киназы YF1, обращая вспять фосфорилирование FixJ и, следовательно, экспрессию cI , что снижает экспрессию lacI и предотвращает экспрессию от lacO-содержащего промотора. Эта цифра была изменена по сравнению с Лалвани и др.6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Здесь мы опишем основные протоколы для контролируемых светом ферментаций S. cerevisiae и E. coli для химического или белкового производства. Как для дрожжей, так и для бактерий мы сначала фокусируемся на ферментациях со световой фазой роста и фазой производства, вызванной темнотой, обеспечиваемой схемами OptoINVRT и OptoLAC. Далее мы описываем протокол для трехфазной (рост, индукция, производство) легко контролируемой ферментации, обеспечиваемой схемами OptoAMP. Кроме того, мы описываем, как масштабировать оптогенетически контролируемые ферментации от микропластин до лабораторных биореакторов. С помощью этого протокола мы стремимся предоставить полное и легко воспроизводимое руководство для выполнения контролируемых светом ферментаций для химического или белкового производства.
Protocol
Representative Results
Discussion
Динамический контроль уже давно применяется для повышения урожайности для метаболической инженерии и производства рекомбинантного белка4. Сдвиги в ферментативной экспрессии чаще всего реализуются с использованием химических индукторов, таких как IPTG21, гала?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано Министерством энергетики США, Управлением науки, Управлением биологических и экологических исследований под номером DE-SC0019363, премией NSF CAREER CBET-1751840, благотворительными фондами Pew Charitable Trusts и премией Камиля Дрейфуса для учителей-ученых.
Materials
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Referências
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioengenharia. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).

