分析编码人类α突触核蛋白的腺相关病毒载体诱导的帕金森病小鼠模型
Summary
这项工作分析了在这种帕金森病临床前模型中诱导神经炎症,神经变性和运动障碍所需的载体剂量和暴露时间。这些编码人α突触核蛋白的载体被递送到黑质中,以概括与帕金森病相关的突触核蛋白病理学。
Abstract
帕金森病是一种神经退行性疾病,涉及黑纹体通路的多巴胺能神经元的死亡,从而导致对自主运动的逐渐失去控制。这种神经退行性过程是由大脑中蛋白质聚集体的沉积引发的,这些聚集体主要由α突触核蛋白组成。一些研究表明,神经炎症是发展与帕金森病相关的神经变性所必需的。值得注意的是,神经炎症过程涉及小胶质细胞活化以及外周T细胞浸润到黑质(SN)中。这项工作分析了帕金森病的小鼠模型,该模型概括了小胶质细胞活化,T细胞浸润到SN,黑质多巴胺能神经元的神经变性和运动障碍。帕金森病的这种小鼠模型是由编码人类野生型α突触核蛋白(AAV-hαSyn)的腺相关病毒载体的立体定位递送诱导到SN中。使用编码绿色荧光蛋白(GFP)的对照载体确认了病毒载体正确递送到SN中。之后,评估了在SN中施用的AAV-hαSyn剂量如何影响hαSyn表达的程度,黑瓜尔多巴胺能神经元的丧失和运动障碍。此外,在疾病发展的整个过程中,hαSyn表达,小胶质细胞活化和T细胞浸润的动力学被测定。因此,本研究提供了关键的时间点,可用于靶向帕金森病临床前模型中的突触核蛋白病理学和神经炎症。
Introduction
在阿尔茨海默病之后,帕金森病是全球第二大最常见的神经退行性疾病。在帕金森病中受影响的原代神经元是黑纹体通路的神经元,其产生多巴胺并控制自主运动。因此,与这种疾病相关的最典型症状是运动障碍。这种病理学还涉及大脑中蛋白质聚集体的沉积,其主要由α突触核蛋白(αSyn)1组成,这是一种与突触前末端相关的胞质蛋白。有证据表明,αSyn的致病性包涵体的产生是由错误折叠或该蛋白2的一些翻译后修饰引发的。
值得注意的是,αSyn病理学与人类帕金森病和动物模型3,4中黑质胸腺体通路的多巴胺能神经元的丧失之间建立了密切的关系。了解αSyn聚集体是如何产生的以及它们如何诱导神经元死亡是该领域的一个重大挑战。越来越多的研究表明,通过增加氧化应激,线粒体功能障碍是产生αSyn聚集体2的主要原因之一。事实上,与帕金森病风险相关的几个基因编码参与线粒体功能,形态学和动力学的蛋白质5,6。此外,溶酶体功能障碍,其导致功能失调的线粒体积累和错误折叠的αSyn构成了促进αSyn聚集体7产生的另一重大事件。
新兴的证据表明,一旦αSyn聚集体沉积在大脑中,这些致病蛋白就会刺激小胶质细胞上的 Toll样受体(TLR),从而触发小胶质细胞活化和黑质(SN)中的初始炎症环境8,9。此外,有证据表明,αSyn聚集体被抗原呈递细胞捕获并呈递给T细胞,诱导αSyn10,11特有的适应性免疫应答。这些αSyn特异性T细胞随后浸润大脑并被活化的小胶质细胞重新刺激,从而促进引起神经元死亡的神经毒性因子的分泌9,10。有趣的是,几条证据表明,αSyn聚集体首先在肠神经系统中产生,然后通过迷走神经运输到脑干12。
帕金森病的几种动物模型已被使用多年,包括由神经毒性物质(即6-羟基多巴胺,百草枯,鱼藤酮,1-甲基-4-苯基-1,2,3,6-四氢吡啶)和涉及遗传疾病的动物模型(即突变α突触核蛋白,突变的富含亮氨酸的重复激酶2)13.尽管涉及神经毒素诱导的神经变性复制帕金森病某些方面的模型,但没有一个概括了该疾病的所有基本方面,或者不是进行性的13。另一方面,尽管遗传小鼠模型涉及富含亮氨酸重复激酶2的突变版本,α突触核蛋白的突变版本或人类野生型α突触核蛋白的过表达导致运动障碍,并且在某些情况下还导致突触核蛋白病的发展,但它们不会再现黑质多巴胺能神经元的显着神经变性,这是帕金森病13的一个重要方面,14.第三种神经变性动物模型已经设法满足了帕金森病的大多数基本方面,即编码人类α突触核蛋白(AAV-hαSyn)的腺相关病毒载体(AAV)的立体定位递送14,15。重要的是,AAV允许具有高疗效的神经元转导,并且长期存在于哺乳动物的成年大脑中。此外,SN中AAV-hαSyn的立体定位递送已被证明可以重现该疾病的许多基本方面,包括αSyn病理学,小胶质细胞活化,神经变性和运动障碍16,17,18,19,20。本研究分析了病毒载体的剂量和病毒载体递送后的时间如何影响黑质胸状体通路中hαSyn表达,神经变性和神经炎症的程度,以及SN中hαSyn的单侧立体定位递送小鼠模型中的运动损伤程度。
Protocol
Representative Results
Discussion
这里分析的神经变性小鼠模型可能有助于研究帕金森病病理生理学中涉及的许多关键方面,包括αSyn病理学和小胶质细胞激活所涉及的机制,周围免疫系统参与神经炎症的调节以及神经变性的机制。在αSyn病理学中涉及的机制包括那些与线粒体,溶酶体或蛋白酶体功能障碍相关的亚细胞机制,在SN2的多巴胺能神经元中存在过量的αSyn负载。重要的是要考虑到,除了由AAV介导的转导诱导的hαSyn表达外,内源性小鼠αSyn也有助于总αSyn表达的负载。过度表达小鼠αSyn的转基因小鼠发展出与基于hαSyn32过表达的小鼠模型相似的突触核蛋白病理学,神经病理学和运动障碍。关于小胶质细胞活化,本小鼠模型可用于研究不同的分子和细胞参与者(如细胞因子,神经递质,星形胶质细胞,神经元,血脑屏障和T细胞)如何调节促炎或抗炎功能表型的获得8,10,11.该模型也构成了研究外周免疫系统(不仅包括T细胞,还包括巨噬细胞,单核细胞和嗜中性粒细胞)在黑神经元神经炎症和神经变性过程中的作用的重要工具11,33,34。最后,该小鼠模型还代表了研究体内神经变性的细胞和分子机制的宝贵系统,包括由内部细胞过程诱导的机制,例如氧化应激,能量缺陷和受损细胞器2,或外部参与者施加的机制,例如小胶质细胞,星形胶质细胞和细胞毒性T细胞8产生的神经毒性因子,28,29,35.
该小鼠模型的局限性是研究αSyn在脑外位置的病理聚集如何构成帕金森病发展的初始阶段36。在这方面,越来越多的证据表明,在黑核神经元的神经变性和运动障碍之前,αSyn病理学始于肠粘膜和嗅觉上皮36,并且可能还有αSyn特异性T细胞反应以及12。之后,αSyn聚集体将通过迷走神经迁移到脑干,触发多巴胺能神经元12的神经炎症和神经变性。尽管AAV-hαSyn模型概括了帕金森病的大多数方面,但在该模型中,αSyn在脑外位置的病理聚集没有明显的参与。涉及适合研究帕金森病这些方面的hαSyn病理学的替代模型可能是转基因小鼠在Thy1启动子Thy1启动子Thy1-SNCA模型37的控制下过度表达hαSyn,其中疾病发展依赖于肠道微生物群并涉及明显的胃肠道损伤38。
虽然它有助于研究与帕金森病病病理生理学相关的各种过程,但目前的小鼠模型涉及应该仔细检查的关键步骤,包括在相应的空间坐标中正确递送病毒载体,hαSyn在神经元中的选择性表达(这取决于AAV血清型和载体构建体), 以及在分析帕金森病表型之前的适当AAV剂量和时间。分析SN中病毒载体的正确递送是必要的,因为当针头不是完全笔直时,使用SN的正确空间坐标可能还不够,这有时是人眼无法察觉的。此外,AAV载体的扩散取决于AAV血清型39。由于这些原因,有必要在含有SN区域的脑切片中观察GFP后,定期进行质量控制,检查注射的AAV-GFP载体的正确传递和扩散。
关于hαSyn在神经元中的选择性表达,原则上,hαSyn的表达可以设计为由对神经元选择性的启动子控制,或者更准确地说,由对多巴胺能神经元选择性的启动子控制,例如在AAV载体中使用TH启动子来诱导多巴胺能神经元中基因的选择性表达40.然而,当所寻求的是目的基因的过表达时,这种策略不起作用。因此,在本模型中,必须使用强启动子(诱导下游基因高表达的启动子)和具有神经元趋向性的AAV血清型。在这项研究中,CBA启动子被用作诱导hαSyn过表达的强启动子,AAV5血清型用于病毒载体。这种血清型以前曾被用于转导小鼠和大鼠神经元41,42。在这里,结果表明,在小鼠SN中递送AAV5-GFP12周后,绿色荧光选择性地存在于SN和纹状体的同侧(图1),表明黑质纹状体通路神经元的有效转导。
帕金森病小鼠模型的另一个关键方面是手术后分析特定过程所需的时间点。在这方面,这项工作显示了涉及病理学的不同过程的动力学研究。由于关键时间点随每只小鼠给予的病毒基因组剂量而变化,因此使用的AAV血清型,甚至与使用的AAV批次一起变化,因此首先对诱导TH +神经元显着损失和运动损伤所需的AAV-αSyn量进行剂量反应分析。先前的研究表明,在小鼠中注射AAV-αSyn12周后,以每只小鼠6 x 108-3 x 10 10病毒基因组16,17,30,31的剂量范围为6 x 10,8-30,10病毒基因组后,存在显着的运动障碍和黑质纹状体通路的TH +神经元的丧失。因此,用于诱导黑质柱状体通路中的hαSyn表达的AAV-hαSyn的剂量,TH +神经元的丢失以及小鼠的运动损伤范围为每只小鼠1×108-1 x10 10病毒基因组。此外,为了控制TH +神经元的丧失和运动损伤是由SN中hαSyn的过表达引起的,而不是由SN神经元的AAV感染引起的,纳入对照组,其中AAV编码报告基因(AAV-eGFP)在小鼠的SN中单侧递送,并确定了神经变性和运动障碍。结果显示,在立体定位手术后12周,每只小鼠1×10 10病毒基因组是适当剂量的AAV5-hαSyn,因为接受该病毒载量的小鼠在黑质面体通路中显示出显着的hαSyn(图2和图3),TH +神经元的损失(图4)和运动障碍(图5)。相比之下,较低剂量的AAV5-hαSyn(每只小鼠1×108个病毒基因组和每只小鼠1×109个病毒基因组)不足以同时实现所有这些参数的显着变化(图2-4)。值得注意的是,在每只小鼠1×10 10病毒基因组中施用AAV-GFP诱导了黑拉多巴胺能神经元的TH +神经元的低(〜20%),但显着程度的损失(图4A,B)。该结果与先前使用该模型41的观察结果一致,并且可能是在SN中施用AAV载体诱导的低水平神经炎症的结果。然而,与接受相同剂量的AAV-GFP的小鼠相比,接受AAV5-hαSyn的小鼠中TH +神经元的损失程度显着更高(图4C)。值得注意的是,hαSyn表达的动力学不仅取决于转导的效率,还取决于AAV扩散39的程度。由于AAV扩散取决于AAV血清型,因此当使用与AAV5不同的另一种AAV血清型时,该动物模型中的确切关键时间点可能会有所不同。
之后,使用每只小鼠1 x 1010病毒基因组进行动力学分析,以确定该小鼠模型中的关键时间点。由于目前的证据已经显示出一些在运动障碍之前出现的早期症状,这将允许帕金森病的早期诊断43,44,这些实验试图找到hαSyn表达已经很明显但在没有运动损伤的情况下的时间点。结果表明,SN中hαSyn表达的发作是在AAV-hαSyn立体定位递送后5周(图6)。这个时间点构成了一个有趣的时间点,可以开始施用旨在阻止神经炎症和神经退行性的治疗。这里确定的其他关键时间点是与神经炎症过程相关的两个关键事件的高峰时间:小胶质细胞达到最大活化程度的时间和最大T细胞浸润到SN的时间。结果显示曲线的趋势达到两波最大小胶质细胞活化,第一波在手术后10周,第二波在手术后15周(图7)。T细胞浸润的动力学分析显示,Treg浸润在立体定位手术后11周进入SN的高峰时间(图8)。令人惊讶的是,在分析的时间范围内(手术后第8-13周),没有检测到效应T细胞(CD4 + Foxp3-)浸润SN。总而言之,这些结果表明,使用这种临床前模型开始施用旨在停止神经炎症过程并减弱T细胞浸润到SN的治疗的适当时间框架,其范围在手术后第5周(hαSyn过表达的发作)和手术后第10周(第一波神经炎症和T细胞浸润)之间(图9)。
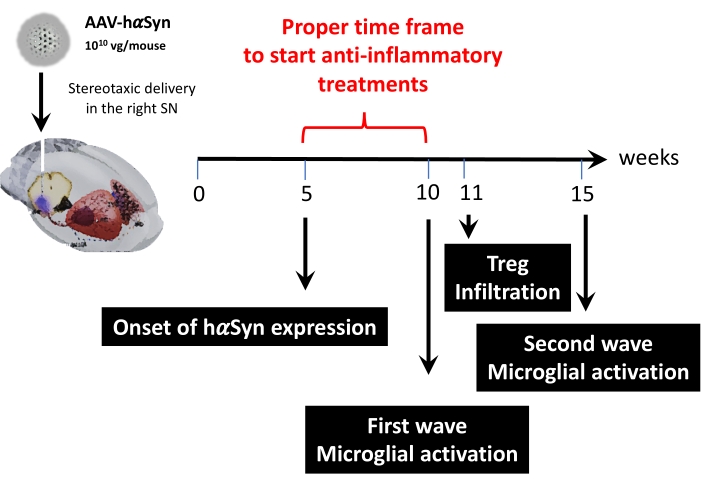
图 9:为该动物模型找到的关键时间点摘要。请单击此处查看此图的放大版本。
Declarações
The authors have nothing to disclose.
Acknowledgements
我们感谢塞巴斯蒂安·巴伦苏埃拉博士和Micaela Ricca博士在我们的动物设施中提供的宝贵兽医帮助。这项工作得到了“Financiamiento Basal para Centros Científicos y Tecnológicos de Excelencia de ANID”Centro Ciencia & Vida,FB210008(到Fondación Ciencia & Vida)和Geroscience Center for Brain Health and Metabolism,FONDAP-15150012的支持。这项工作还得到了来自“智利国家调查和研究协会”的FONDECYT-1210013(对R.P.)和FONDECYT-1150766(对F.C.)的资助,以及来自Michael J Fox帕金森氏症研究基金会的MJFF-10332.01(对R.P.)和MJFF-17303(到F.C.)。
Materials
| ANIMALS AND ANIMAL FOOD | |||
| Foxp3-GFP C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 023800 | |
| Laboratory Rodent Diet | LabDiet | Rodent Diet 5001 | Standard Rodent diet |
| Wild-type C57BL/6 mice | The Jackson Laboratory (Bar Harbor, ME) | Stock No: 000664 | |
| VIRAL VECTORS | |||
| AAV5-CBA-αSyn | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 10E13 vg/mL |
| AAV5-CBA-eGFP | University of Iowa Viral Vector Core Facility | N/A | Stock concentration at 9.5 x 10E12 vg/mL |
| ANESTHETICS AND ANALGESICS | |||
| Isoflurane | Baxter | 218082 | 1% for stereotaxic surgery |
| Ketamine | Drag Pharma | CHE30 | 70 mg/Kg for stereotaxic surgery |
| Sevoflurane | Baxter | VE2L9117 | For before transcardial perfusion |
| Tramadol | Drag Pharma | DPH134 | 30 mg/Kg every 24 h |
| Xylazine | Centrovet | EHL40 | 9 mg/kg for stereotaxic surgery |
| EQUIPMENT | |||
| Beam test | Home made | N/A | horizontal beam 25 cm length and 3 cm width. The beam surface was covered by a metallic grid (1 cm2). |
| Cryostate | Leica | CM1520 | |
| Digital camera | Nikon | S2800 Coolpix | For recording the beam test performance |
| Microscope | Olympus | BX51 | Used for IHC analysis (section 4.4) |
| Microscope | Olympus | IX71 | Used for IF analysis (section 5.3) |
| Microscope | Leica | DMI8 | Used for IF analysis (section 5.7) |
| New Standard Stereotaxic, mouse | Stoelting, Wood Dale, IL, USA | 51500 | stereotaxic frame for surgery |
| Peristaltic Pump | Masterflex | C-flex L/S16 | |
| Power supply unit | Olympus | U-RFL-T | Used for IF analysis (section 5.3) |
| Surgical suture | Sylkam®, B Braun | C0760171 | |
| Syringe 100 U | BD | 324918 | For anesthesia before transcardial perfusion, 29G needle |
| Syringe RN 5uL SYR W/O NEEDLE | Hamilton | HA-7641-01 | For viral vector innoculation |
| BUFFERS AND REAGENTS | |||
| Aviden, Peroxidase Conjugate | Merck, Darmstadt, Germany | 189728 | |
| Bovine Serum Albumin | Merck, Darmstadt, Germany | 9048-46-8 | |
| Cryotrotection buffer | Home made | N/A | 20% glycerine and 2% DMSO in PBS |
| DAPI | Abcam | ab228549 | |
| Diaminobenzidine | Merck, Darmstadt, Germany | D8001 | |
| Fluoromount -G T | Electron Microscopy Science | 17984-25 | |
| Gelatin | Merck, Darmstadt, Germany | 104078 | |
| Normal goat serum | Jackson ImmunoResearch Laboratory | 5000121 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 104005 | |
| PBS | Home made | N/A | 0.125 M, pH 7.4 |
| Peroxidase inactivating buffer | Home made | N/A | 0.03% H2O2 in methanol |
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| Trizma Hydrochloride | Merck, Darmstadt, Germany | 1185-53-1 | |
| Tween 20 | Sigma-Aldrich | 822184 | |
| ANTIBODIES | |||
| Biotin-SP (long spacer) AffiniPure Goat Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch Laboratory | 111065003 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11010 | |
| Goat anti-Rabbit IgG (H+L) Alexa Fluor 647 | ThermoFisher Scientific | A21244 | |
| Goat anti-Rat IgG (H+L) Alexa Fluor 546 | ThermoFisher Scientific | A11081 | |
| Rabbit monoclonal anti-alpha-Synuclein | Abcam | ab138501 | |
| Rabbit monoclonal anti-Iba-1 | Abcam | EPR16588 | |
| Rabbit polyclonal anti-Tyrosine Hydroxylase | Millipore | AB152 | |
| Rat monoclonal anti-CD4 | Biolegend | 100402 | |
| SOFTWARES | |||
| GraphPad | Prism | 6.0 | Fos stats analysis |
| ImageJ | National Institute of Health | N/A | For image analysis |
| LAS X | Leica | N/A | For image capture with Leica microscope |
| ProgRes Capture Pro | Jenoptik | N/A | For image capture with Olympus microscope |
| VLC media player | VideoLAN Organization | N/A | For analysis of behavioural tests |
Referências
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging. 24 (2), 197-211 (2003).
- Lim, K. L., Zhang, C. W. Molecular events underlying Parkinson’s disease – An interwoven tapestry. Frontiers in Neurology. 4, 33 (2013).
- Abdelmotilib, H., et al. α-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Mori, F., et al. Relationship among alpha-synuclein accumulation, dopamine synthesis, and neurodegeneration in Parkinson disease substantia nigra. The Journal of Neuropathology & Experimental Neurology. 65 (8), 808-815 (2006).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson’s disease. Biochimica et Biophysica Acta. 1802 (1), 29-44 (2010).
- Vazquez-Velez, G. E., Zoghbi, H. Y. Parkinson’s disease genetics and pathophysiology. Annual Review of Neuroscience. 44, 87-108 (2021).
- Dehay, B., et al. Lysosomal impairment in Parkinson’s disease. Movement Disorders. 28 (6), 725-732 (2013).
- Gonzalez, H., Elgueta, D., Montoya, A., Pacheco, R. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. Journal of Neuroimmunology. 274 (1-2), 1-13 (2014).
- Pacheco, R. T-cell based immunotherapies for Parkinson’s disease. Exploration of Neuroprotective Therapy. 1 (2), 72-85 (2021).
- Gonzalez, H., Contreras, F., Pacheco, R. Regulation of the neurodegenerative process associated to Parkinson’s disease by CD4+ T-cells. Journal of Neuroimmune Pharmacology. 10 (4), 561-575 (2015).
- Gonzalez, H., Pacheco, R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. Journal of Neuroinflammation. 11 (1), 201 (2014).
- Campos-Acuna, J., Elgueta, D., Pacheco, R. T-cell-driven inflammation as a mediator of the gut-brain axis involved in Parkinson’s disease. Frontiers in Immunology. 10, 239 (2019).
- Blesa, J., Phani, S., Jackson-Lewis, V., Przedborski, S. Classic and new animal models of Parkinson’s disease. Journal of Biomedicine and Biotechnology. 2012, 845618 (2012).
- Ulusoy, A., Decressac, M., Kirik, D., Bjorklund, A. Viral vector-mediated overexpression of alpha-synuclein as a progressive model of Parkinson’s disease. Progress in Brain Research. 184, 89-111 (2010).
- Gomez-Benito, M., et al. Modeling Parkinson’s disease with the alpha-synuclein protein. Frontiers in Pharmacology. 11, 356 (2020).
- Song, L. K., et al. Targeted overexpression of alpha-synuclein by rAAV2/1 vectors induces progressive nigrostriatal degeneration and increases vulnerability to MPTP in mouse. PLoS One. 10 (6), 0131281 (2015).
- Theodore, S., Cao, S., McLean, P. J., Standaert, D. G. Targeted overexpression of human alpha-synuclein triggers microglial activation and an adaptive immune response in a mouse model of Parkinson disease. Journal of Neuropathology and Experimental Neurology. 67 (12), 1149-1158 (2008).
- Sanchez-Guajardo, V., Annibali, A., Jensen, P. H., Romero-Ramos, M. alpha-Synuclein vaccination prevents the accumulation of parkinson disease-like pathologic inclusions in striatum in association with regulatory T cell recruitment in a rat model. Journal of Neuropathology and Experimental Neurology. 72 (7), 624-645 (2013).
- Sanchez-Guajardo, V., Febbraro, F., Kirik, D., Romero-Ramos, M. Microglia acquire distinct activation profiles depending on the degree of alpha-synuclein neuropathology in a rAAV based model of Parkinson’s disease. PLoS One. 5 (1), 8784 (2010).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Molecular Neurodegeneration. 8, 44 (2013).
- Cho, C., et al. Evaluating analgesic efficacy and administration route following craniotomy in mice using the grimace scale. Scientific Reports. 9 (1), 359 (2019).
- Flecknell, P. . Laboratory Animal Anaesthesia. 3rd Ed. , (2009).
- Bind, R. H., Minney, S. M., Rosenfeld, S., Hallock, R. M. The role of pheromonal responses in rodent behavior: Future directions for the development of laboratory protocols. Journal of the American Association for Laboratory Animal Science. 52 (2), 124-129 (2013).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Elgueta, D., et al. Dopamine receptor D3 expression is altered in CD4+ T-cells from Parkinson’s disease patients and its pharmacologic inhibition attenuates the motor impairment in a mouse model. Frontiers in Immunology. 10, 981 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Fernandez-Suarez, D., et al. The monoacylglycerol lipase inhibitor JZL184 is neuroprotective and alters glial cell phenotype in the chronic MPTP mouse model. Neurobiology of Aging. 35 (11), 2603-2616 (2014).
- Elgueta, D., et al. Pharmacologic antagonism of dopamine receptor D3 attenuates neurodegeneration and motor impairment in a mouse model of Parkinson’s disease. Neuropharmacology. 113, 110-123 (2017).
- Montoya, A., et al. Dopamine receptor D3 signalling in astrocytes promotes neuroinflammation. Journal of Neuroinflammation. 16 (1), 258 (2019).
- Williams, G. P., et al. Targeting of the class II transactivator attenuates inflammation and neurodegeneration in an alpha-synuclein model of Parkinson’s disease. Journal of Neuroinflammation. 15 (1), 244 (2018).
- Benskey, M. J., et al. Silencing alpha synuclein in mature nigral neurons results in rapid neuroinflammation and subsequent toxicity. Frontiers in Molecular Neuroscience. 11, 36 (2018).
- Rieker, C., et al. Neuropathology in mice expressing mouse alpha-synuclein. PLoS One. 6 (9), 24834 (2011).
- Harms, A. S., et al. alpha-Synuclein fibrils recruit peripheral immune cells in the rat brain prior to neurodegeneration. Acta Neuropathologica Communications. 5 (1), 85 (2017).
- Williams, G. P., et al. CD4 T cells mediate brain inflammation and neurodegeneration in a mouse model of Parkinson disease. Brain. 144 (7), 2047-2059 (2021).
- Matheoud, D., et al. Intestinal infection triggers Parkinson’s disease-like symptoms in Pink1(-/-) mice. Nature. 571 (7766), 565-569 (2019).
- Jan, A., Goncalves, N. P., Vaegter, C. B., Jensen, P. H., Ferreira, N. The prion-like spreading of alpha-synuclein in Parkinson’s disease: Update on models and hypotheses. International Journal of Molecular Sciences. 22 (15), 8338 (2021).
- Chesselet, M. F., et al. A progressive mouse model of Parkinson’s disease: The Thy1-aSyn ("Line 61") mice. Neurotherapeutics. 9 (2), 297-314 (2012).
- Sampson, T. R., et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell. 167 (6), 1469-1480 (2016).
- Ciron, C., et al. Human alpha-iduronidase gene transfer mediated by adeno-associated virus types 1, 2, and 5 in the brain of nonhuman primates: Vector diffusion and biodistribution. Human Gene Therapy. 20 (4), 350-360 (2009).
- Ben-Shaanan, T. L., et al. Activation of the reward system boosts innate and adaptive immunity. Nature Medicine. 22 (8), 940-944 (2016).
- Albert, K., Voutilainen, M. H., Domanskyi, A., Airavaara, M. AAV vector-mediated gene delivery to substantia nigra dopamine neurons: Implications for gene therapy and disease models. Genes. 8 (2), 63 (2017).
- Bordia, T., Perez, X. A., Heiss, J., Zhang, D., Quik, M. Optogenetic activation of striatal cholinergic interneurons regulates L-dopa-induced dyskinesias. Neurobiology of Disease. 91, 47-58 (2016).
- Kim, A., et al. Upgraded methodology for the development of early diagnosis of Parkinson’s disease based on searching blood markers in patients and experimental models. Molecular Neurobiology. 56 (5), 3437-3450 (2018).
- Lei, H., et al. Parkinson’s disease diagnosis via joint learning from multiple modalities and relations. IEEE Journal of Biomedical and Health Informatics. 23 (4), 1437-1449 (2018).

