Estrazione e purificazione della proteina FAHD1 dal rene suino e dal fegato di topo
Summary
Questo protocollo descrive come estrarre la proteina 1 contenente dominio della fumarilacetoacetato idrolasi (FAHD1) dal rene suino e dal fegato di topo. I metodi elencati possono essere adattati ad altre proteine di interesse e modificati per altri tessuti.
Abstract
La proteina 1 contenente dominio fumarilacetato idrolasi (FAHD1) è il primo membro identificato della superfamiglia FAH negli eucarioti, che agisce come ossalacetato decarbossilasi nei mitocondri. Questo articolo presenta una serie di metodi per l’estrazione e la purificazione di FAHD1 dal rene suino e dal fegato di topo. I metodi coperti sono la cromatografia a scambio ionico con cromatografia liquida proteica veloce (FPLC), la filtrazione preparativa e analitica del gel con FPLC e gli approcci proteomici. Dopo l’estrazione totale delle proteine, sono state esplorate la precipitazione del solfato di ammonio e la cromatografia a scambio ionico e FAHD1 è stato estratto tramite una strategia sequenziale utilizzando lo scambio ionico e la cromatografia ad esclusione dimensionale. Questo approccio rappresentativo può essere adattato ad altre proteine di interesse (espresse a livelli significativi) e modificato per altri tessuti. Le proteine purificate dai tessuti possono supportare lo sviluppo di anticorpi di alta qualità e/o inibitori farmacologici potenti e specifici.
Introduction
La proteina 1 contenente dominio FAH eucariotico (FAHD1) agisce come ossalacetato bifunzionale (OAA) decarbossilasi (ODx)1 e idrolasi acilpropurato (ApH)2. È localizzato nei mitocondri2 e appartiene all’ampia superfamiglia FAH degli enzimi 1,2,3,4,5,6. Mentre la sua attività ApH è solo di minore rilevanza, l’attività ODx di FAHD1 è coinvolta nella regolazione del flusso del ciclo TCA 1,7,8,9. L’OAA non è solo richiesto per la reazione centrale della citrato sintasi nel ciclo dell’acido tricarbossilico, ma agisce anche come inibitore competitivo della succinato deidrogenasi come parte del sistema di trasporto degli elettroni e come metabolita cataplerotico. La downregulation dell’espressione genica di FAHD1 nelle cellule endoteliali della vena ombelicale umana (HUVEC) ha determinato una significativa riduzione del tasso di proliferazione cellulare10 e una significativa inibizione del potenziale di membrana mitocondriale, associata a un concomitante passaggio alla glicolisi. Il modello di lavoro si riferisce alla senescenza associata alla disfunzione mitocondriale (MiDAS)11-like fenotipo8, in cui i livelli di OAA mitocondriale sono strettamente regolati dall’attività FAHD1 1,8,9.
La proteina ricombinante è più facile da ottenere attraverso l’espressione e la purificazione dai batteri12 piuttosto che dai tessuti. Tuttavia, una proteina espressa nei batteri può essere influenzata dalla possibile mancanza di modifiche post-traduzionali, o può semplicemente essere problematica (ad esempio, a causa della perdita di plasmidi, risposte allo stress batterico, legami disolfuro distorti / non formati, nessuna o scarsa secrezione, aggregazione proteica, scissione proteolitica, ecc.). Per alcune applicazioni, le proteine devono essere ottenute dal lisato cellulare o dal tessuto, al fine di includere tali modifiche e/o di escludere possibili artefatti. La proteina purificata dai tessuti supporta lo sviluppo di anticorpi di alta qualità e/o inibitori farmacologici potenti e specifici per enzimi selezionati, come per FAHD113.
Questo manoscritto presenta una serie di metodi per l’estrazione e la purificazione di FAHD1 dal rene suino e dal fegato di topo. I metodi descritti richiedono una cromatografia liquida proteica veloce (FPLC), ma per il resto utilizzano apparecchiature di laboratorio comuni. Metodi alternativi possono essere trovati altrove 14,15,16,17. Dopo l’estrazione totale delle proteine, il protocollo proposto prevede una fase di test, in cui vengono discussi i sottoprotocolli per la precipitazione del solfato di ammonio e la cromatografia a scambio ionico (Figura 1). Dopo aver definito questi sotto-protocolli, la proteina di interesse viene estratta attraverso una strategia sequenziale utilizzando lo scambio ionico e la cromatografia di esclusione dimensionale con FPLC. Sulla base di queste linee guida, il protocollo finale può essere adattato individualmente per altre proteine di interesse.
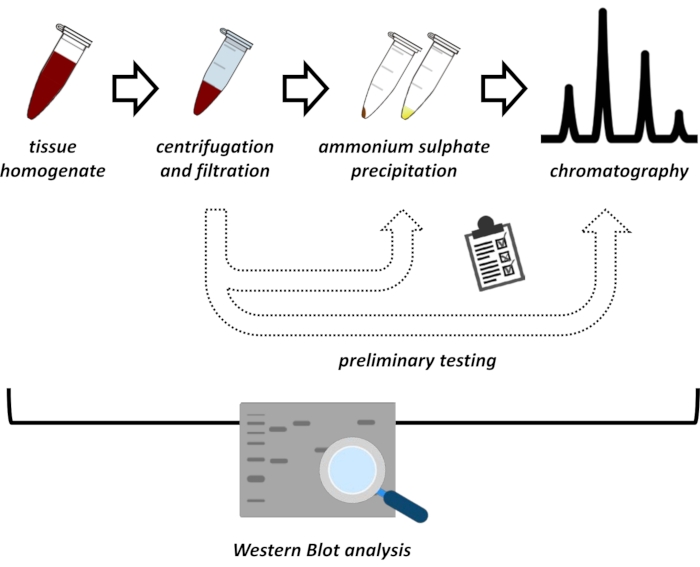
Figura 1: La strategia generale di questo protocollo. Dall’alto verso il basso: le proteine vengono estratte dai tessuti. L’omogeneizzato tissutale viene preparato, centrifugato e filtrato. Per ogni coppia di campioni surnatante e derivati da pellet, è necessario eseguire test per la precipitazione del solfato di ammonio e la cromatografia a scambio ionico (FPLC) per sondare le condizioni ottimali. Dopo aver stabilito questi sotto-protocolli, la proteina può essere estratta tramite una procedura sequenziale di precipitazione del solfato di ammonio, cromatografia a scambio ionico e cromatografia di esclusione di dimensioni ripetitive (FPLC) a diverse concentrazioni di pH e sale. Tutti i passaggi devono essere controllati da western blot. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Passaggi critici nel protocollo
Seguire le linee guida comuni per la manipolazione delle proteine è essenziale, come lavorare sul ghiaccio e in condizioni di pH e sale moderate. L’uso di inibitori della proteasi è benefico per il metodo, mentre l’uso di inibitori del proteasoma è altamente raccomandato. Il congelamento e lo scongelamento del campione possono sempre comportare la precipitazione proteica (almeno parzialmente), pertanto qualsiasi aliquota scongelata del lisato proteico iniziale (fase …
Declarações
The authors have nothing to disclose.
Acknowledgements
Gli autori sono molto grati per l’assistenza tecnica di Ayse Öztürk ed Eva Albertini. I topi utilizzati per la generazione di tessuto epatico sono stati mantenuti sotto la supervisione di Univ.-Doz. Dr. Pidder Jansen-Dürr (Istituto per la ricerca sull’invecchiamento biomedico presso l’Università di Innsbruck, Rennweg 10, 6020 Innsbruck, Austria).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
Referências
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

