הסרת עיניים בזחלי דגי זברה חיים לבחינת גדילה והתפתחות תלויי עצבנות של מערכת הראייה
Summary
המאמר מסביר כיצד להסיר באופן כירורגי עיניים מזחלי דגי זברה חיים כצעד ראשון לקראת חקירת האופן שבו קלט רשתית משפיע על צמיחת והתפתחות של טקטום אופטי. בנוסף, המאמר מספק מידע על הרדמה של זחלים, קיבוע וכריתת מוח, ולאחר מכן אימונוהיסטוכימיה והדמיה קונפוקלית.
Abstract
דגי זברה מפגינים יכולות צמיחה והתחדשות יוצאות דופן לאורך כל החיים. לדוגמה, נישות מיוחדות של תאי גזע שהוקמו במהלך העובריות תומכות בצמיחה מתמשכת של מערכת הראייה כולה, הן בעין והן במוח. צמיחה מתואמת בין הרשתית לבין טקטום אופטי מבטיחה מיפוי רטינוטופי מדויק כאשר נוירונים חדשים מתווספים לעיניים ולמוח. כדי לענות על השאלה אם אקסונים של הרשתית מספקים מידע חיוני לוויסות התנהגויות של גזע טקטלי ותאי אב כגון הישרדות, התפשטות ו/או התמיינות, יש צורך להיות מסוגלים להשוות אונות טקטליות מופנמות ומנוכרות בתוך אותה חיה ובין בעלי חיים.
הסרה כירורגית של עין אחת מדגי זברה זחליים חיים ולאחר מכן תצפית על טקטום אופטי משיגה מטרה זו. הסרטון הנלווה מדגים כיצד להרדים זחלים, לחדד באופן אלקטרוליטי מחטי טונגסטן ולהשתמש בהם כדי להסיר עין אחת. לאחר מכן הוא מראה כיצד לנתח מוחות מזחלי דגי זברה קבועים. לבסוף, הסרטון מספק סקירה כללית של הפרוטוקול לאימונוהיסטוכימיה והדגמה כיצד להרכיב עוברים מוכתמים באגרוז בעל נקודת התכה נמוכה לצורך מיקרוסקופיה.
Introduction
מטרת שיטה זו היא לחקור כיצד קלט רשתית משפיע על הגדילה וההתפתחות של טקטום אופטי, מרכז העיבוד החזותי במוח דגי הזברה. על ידי הסרת עין אחת ולאחר מכן השוואת שני הצדדים של טקטום אופטי, ניתן לצפות ולנרמל שינויים טקטליים בתוך אותה דגימה, מה שמאפשר השוואה בין דגימות מרובות. גישות מולקולריות מודרניות בשילוב עם טכניקה זו יניבו תובנות על המנגנונים העומדים בבסיס הצמיחה וההתפתחות של מערכת הראייה, כמו גם על ניוון והתחדשות אקסונאלית.
מערכות חושיות – חזותיות, שמיעתיות וסומטוסנסוריות – אוספות מידע מאיברים חיצוניים ומעבירות את המידע הזה למערכת העצבים המרכזית, ויוצרות “מפות” של העולם החיצוני על פני המוח האמצעי 1,2. ראייה היא השיטה החושית הדומיננטית עבור כמעט כל בעלי החוליות, כולל דגים רבים. הרשתית, הרקמה העצבית בעין, אוספת מידע עם מעגל עצבי המורכב בעיקר מפוטורצפטורים, תאים דו קוטביים ותאי גנגליון רשתית (RGCs), נוירוני ההקרנה של הרשתית. ל-RGCs יש אקסונים ארוכים שמוצאים את דרכם על פני השטח הפנימיים של הרשתית אל ראש עצב הראייה, שם הם מתפתלים ונעים יחד דרך המוח, ובסופו של דבר מסתיימים במרכז העיבוד החזותי במוח האמצע הגבי. מבנה זה נקרא טקטום אופטי בדגים ובבעלי חוליות אחרים שאינם יונקים והוא הומולוגי לקוליקולוס העליון ביונקים3.
טקטום אופטי הוא מבנה רב שכבתי סימטרי דו-צדדי במוח האמצע הגבי. בדגי זברה וברוב הדגים האחרים, כל אונה של טקטום אופטי מקבלת קלט חזותי אך ורק מהעין הקונטרולטרלית, כך שעצב הראייה השמאלי מסתיים באונה הטקטלית הימנית ועצב הראייה הימני מסתיים באונה הטקטלית השמאלית4 (איור 1). בדומה למקבילו היונקים, הקוליקולוס המעולה, טקטום אופטי משלב מידע חזותי עם קלטים חושיים אחרים, כולל אודישן וסומטוסנסציה, שליטה בשינויים בקשב החזותי ובתנועות עיניים כגון סקאדות 1,5,6. עם זאת, שלא כמו הקוליקולוס העליון של היונקים, הטקטום האופטי מייצר ברציפות נוירונים וגליה חדשים מגומחת תאי גזע מיוחדת ליד הקצוות המדיאליים והקאודלים של האונות הטקטליות הנקראות אזור ההתרבותהטקטלית 7. תחזוקה של אבות מתרבים בטקטום האופטי ובאזורים אחרים במערכת העצבים המרכזית תורמת, בין השאר, ליכולת ההתחדשות המדהימה המתועדת בדגי זברה8.
עבודות קודמות שבחנו את מוחותיהם של דגים עיוורים או חדי עין גילו כי גודל טקטום אופטי עומד ביחס ישר לכמות העצבנות ברשתית שהוא מקבל 9,10,11. בדגי מערות בוגרים, שעיניהם מתנוונות באמבריוגנזה מוקדמת, טקטום הראייה קטן באופן ניכר מזה של דגי פני השטח הקרובים, בעלי הראייה הקרובה9. ניתן לחסום את ניוון העיניים של דגי המערות על ידי החלפת העדשה האנדוגנית בעדשה של דג פני השטח במהלך העובר. כאשר דגי מערות חדי עין אלה גדלים לבגרות, האונה הטקטלית העצבנית מכילה כ-10% יותר תאים מאשר האונה הטקטלית שאינה מוחננת9. באופן דומה, בדגי קטל זחלים שעברו טיפולים כימיים כדי ליצור עיניים בגדלים שונים בתוך אותו אדם, הצד של הטקטום עם יותר עצבנות היה גדול יותר והכיל יותר נוירונים10. עדויות מניסויים בריסוק עצבי ראייה בדגי זהב בוגרים מצביעות על כך שהתרבות העצבנות מקדמת התפשטות, כאשר התפשטות תאי הכרק פוחתת כאשר העצבנות שובשה11.
כדי לאשר ולהרחיב את המחקרים הקלאסיים האלה, כמה דיווחים עדכניים מספקים נתונים המצביעים על כך שהתפשטות בתגובה להפנמה מווסתת, לפחות בחלקה, על ידי מסלול BDNF-TrkB12,13. שאלות פתוחות רבות לגבי גדילה והתפתחות של טקטום אופטי נותרו בעינן, כולל כיצד מערכת חושית מתפתחת מתמודדת עם פציעה וניוון אקסון, אילו אותות תאיים ומולקולריים מאפשרים לקלט רשתית לווסת את צמיחת הטקטום האופטי, מתי מנגנונים אלה הופכים לפעילים, והאם התפשטות והתמיינות הקשורות לעירוי העצבנות מאפשרות לרשתית ולרקמת היעד שלה לתאם את קצבי הגדילה ולהבטיח מיפוי רטינוטופי מדויק. בנוסף, ישנן שאלות הרבה יותר גדולות על התפתחות תלוית פעילות שניתן לטפל בהן על ידי חקירת מערכת הראייה של דגי הזברה עם גישות כירורגיות כמו זו המתוארת להלן.
כדי לחקור את המנגנונים התאיים והמולקולריים שבאמצעותם פעילות עצבית, במיוחד מתוך קלט חזותי, משנה את הישרדות התאים ואת התפשטותם, הגישה המתוארת משווה באופן ישיר בין אונות טקטליות עצבוניות ומנוכרות (איור 1) בתוך זחלי דגי זברה בודדים. שיטה זו מאפשרת תיעוד של התנוונות אקסון RGC בטקטום האופטי ואישור לכך שמספר התאים המיטוטיים מתואם עם העצבנות.
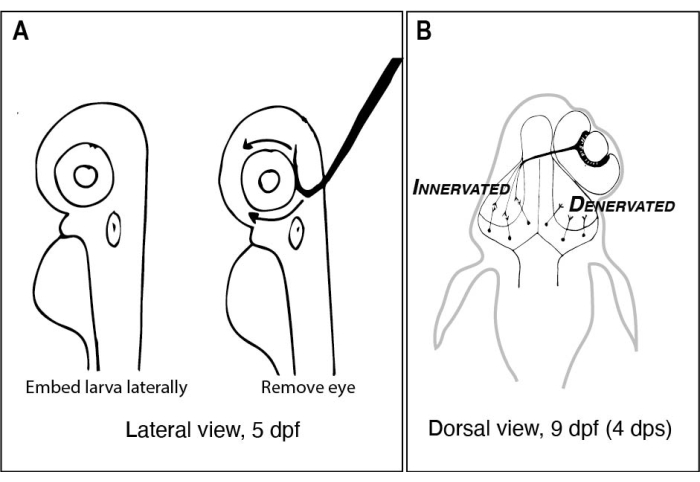
איור 1: רישומים של זחלי דגי זברה לפני ואחרי הסרת עיניים חד-צדדית. (A) ציור של 5 זחלי dpf כפי שנצפו תחת מיקרוסקופ מנתח. כל זחל משובץ באגרוז בעל נקודת התכה נמוכה ומכוון לרוחב לפני שמחט טונגסטן עם קצה חד ומחובר משמשת כדי להוציא את העין הפונה כלפי מעלה (עין שמאל בדוגמה זו). (B) ציור הנוף הגבי של זחל 9 dpf כתוצאה מהניתוח המתואר ב-A. רק שלושה אקסוני RGC שעברו מיפוי גבוה מעין ימין נראים מתייבשים ומתחברים לנוירונים באונה הטקטלית השמאלית. קיצורים: dpf = ימים לאחר ההפריה; dps = ימים לאחר הניתוח; RGC = תאי גנגליון רשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
הטכניקות המתוארות במאמר זה ממחישות אחת מגישות רבות לחקר התפתחות מערכת הראייה של בעלי חוליות בדגי זברה. חוקרים אחרים פרסמו שיטות לנתח את הרשתית העוברית ולבצע ניתוחי ביטוי גנים19 או לדמיין פעילות עצבית בטקטום אופטי30. מאמר זה מספק גישה לבחינת האופן שבו קלט רשתית דיפ…
Declarações
The authors have nothing to disclose.
Acknowledgements
המימון לעבודה זו נתמך בעיקר על ידי קרנות סטארט-אפ ממכללת ריד ל-KLC, קרנות מלגת המחקר של הלן סטאפורד ל-OLH, ומלגת מחקר מדעי של מכללת ריד ל-YK. פרויקט זה החל במעבדתו של סטיב וילסון כשיתוף פעולה עם משאבי אנוש, שנתמך על ידי סטודנטית של Wellcome Trust (2009-2014). אנו מודים למט וארגה, סטיב וילסון וחברים אחרים במעבדת וילסון על הדיונים הראשוניים על הפרויקט הזה, ואנו מודים במיוחד לפלורנסיה קאבודאסי וקייט אדוארדס, שהיו הראשונות שלימדו את KLC כיצד להרכיב עוברים באגרוס ולבצע ניתוחי מוח של דגי זברה. אנו מודים גם לגרטה גלובר ולג’יי יואינג על העזרה בהרכבת המכשיר שלנו להשחזת מחט טונגסטן.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
Referências
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

