Realización de miografía de impedancia eléctrica de vivo y ex vivo en roedores
Summary
Este artículo detalla cómo realizar una miografía de impedancia eléctrica in vivo (usando matrices de electrodos de superficie y aguja) y ex vivo (usando una celda dieléctrica) en el músculo gastrocnemio de roedores. Demostrará la técnica tanto en ratones como en ratas y detallará las modificaciones disponibles (es decir, animales obesos, cachorros).
Abstract
La miografía de impedancia eléctrica (EIM) es una técnica conveniente que se puede utilizar en estudios preclínicos y clínicos para evaluar la salud y la enfermedad del tejido muscular. EIM se obtiene aplicando una corriente eléctrica de baja intensidad, enfocada direccionalmente, a un músculo de interés en un rango de frecuencias (es decir, de 1 kHz a 10 MHz) y registrando los voltajes resultantes. A partir de estos, se obtienen varios componentes de impedancia estándar, incluyendo la reactancia, la resistencia y la fase. Al realizar mediciones ex vivo en el músculo extirpado, también se pueden calcular las propiedades eléctricas pasivas inherentes del tejido, a saber, la conductividad y la permitividad relativa. EIM se ha utilizado ampliamente en animales y humanos para diagnosticar y rastrear alteraciones musculares en una variedad de enfermedades, en relación con la atrofia simple por desuso, o como una medida de intervención terapéutica. Clínicamente, EIM ofrece el potencial de rastrear la progresión de la enfermedad a lo largo del tiempo y evaluar el impacto de las intervenciones terapéuticas, ofreciendo así la oportunidad de acortar la duración del ensayo clínico y reducir los requisitos de tamaño de la muestra. Debido a que se puede realizar de forma no invasiva o mínimamente invasiva en modelos animales vivos, así como en humanos, EIM ofrece el potencial de servir como una nueva herramienta traslacional que permite el desarrollo preclínico y clínico. Este artículo proporciona instrucciones paso a paso sobre cómo realizar mediciones de EIM de vivo y ex vivo en ratones y ratas, incluidos enfoques para adaptar las técnicas a condiciones específicas, como para su uso en cachorros o animales obesos.
Introduction
La miografía de impedancia eléctrica (EIM) proporciona un método poderoso para evaluar la condición muscular, lo que potencialmente permite el diagnóstico de trastornos neuromusculares, el seguimiento de la progresión de la enfermedad y la evaluación de la respuesta a la terapia 1,2,3. Se puede aplicar de manera análoga a modelos de enfermedades animales y humanos, lo que permite una traducción relativamente fluida de estudios preclínicos a clínicos. Las mediciones de EIM se obtienen fácilmente utilizando cuatro electrodos colocados linealmente, con los dos externos aplicando una corriente eléctrica débil e indolora en un rango de frecuencias (generalmente entre 1 kHz y aproximadamente 2 MHz), y los dos internos registrando los voltajes resultantes1. A partir de estos voltajes, se pueden obtener las características de impedancia del tejido, incluida la resistencia (R), una medida de cuán difícil es que la corriente pase a través del tejido, y la reactancia (X) o “cargabilidad” del tejido, una medida relacionada con la capacidad del tejido para almacenar carga (capacitancia). A partir de la reactancia y la resistencia, el ángulo de fase (θ) se calcula mediante la siguiente ecuación: 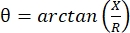 , proporcionando una única medida de impedancia sumativa. Dichas mediciones se pueden obtener utilizando cualquier dispositivo de bioimpedancia multifrecuencia. Como las miofibras son esencialmente cilindros largos, el tejido muscular también es altamente anisótropo, con corriente que fluye más fácilmente a lo largo de las fibras que a través de ellas 4,5. Por lo tanto, EIM a menudo se realiza en dos direcciones: con la matriz colocada a lo largo de las fibras de tal manera que la corriente corre paralela a ellas, y a través del músculo de tal manera que la corriente fluye perpendicular a ellas. Además, en las mediciones ex vivo, donde se mide un volumen conocido de tejido en una celda de medición de impedancia, se pueden derivar las propiedades eléctricas inherentes del músculo (es decir, la conductividad y la permitividad relativa)6.
, proporcionando una única medida de impedancia sumativa. Dichas mediciones se pueden obtener utilizando cualquier dispositivo de bioimpedancia multifrecuencia. Como las miofibras son esencialmente cilindros largos, el tejido muscular también es altamente anisótropo, con corriente que fluye más fácilmente a lo largo de las fibras que a través de ellas 4,5. Por lo tanto, EIM a menudo se realiza en dos direcciones: con la matriz colocada a lo largo de las fibras de tal manera que la corriente corre paralela a ellas, y a través del músculo de tal manera que la corriente fluye perpendicular a ellas. Además, en las mediciones ex vivo, donde se mide un volumen conocido de tejido en una celda de medición de impedancia, se pueden derivar las propiedades eléctricas inherentes del músculo (es decir, la conductividad y la permitividad relativa)6.
El término “trastornos neuromusculares” define una amplia gama de enfermedades primarias y secundarias que conducen a la alteración y disfunción muscular estructural. Esto incluye la esclerosis lateral amiotrófica y varias formas de distrofia muscular, así como cambios más simples relacionados con el envejecimiento (por ejemplo, sarcopenia), atrofia por desuso (por ejemplo, debido a reposo prolongado en cama o microgravedad) o incluso lesiones7. Si bien las causas son abundantes y pueden originarse en la neurona motora, los nervios, las uniones neuromusculares o el músculo en sí, EIM se puede usar para detectar alteraciones tempranas en el músculo debido a muchos de estos procesos y para rastrear la progresión o la respuesta a la terapia. Por ejemplo, en pacientes con distrofia muscular de Duchenne (DMD), EIM ha demostrado detectar la progresión de la enfermedad y la respuesta a los corticosteroides8. Trabajos recientes también han demostrado que EIM es sensible a diferentes estados de desuso, incluida la gravedad fraccional9, como se experimentaría en la Luna o Marte, y los efectos del envejecimiento10,11. Finalmente, mediante la aplicación de algoritmos predictivos y de aprendizaje automático al conjunto de datos obtenidos con cada medición (datos multifrecuencia y dependientes direccionalmente), es posible inferir aspectos histológicos del tejido, incluyendo el tamaño de la miofibra 12,13, los cambios inflamatorios y edema 14, y el tejido conectivo y el contenido de grasa 15,16.
Varios otros métodos no invasivos o mínimamente invasivos también se utilizan para evaluar la salud muscular en humanos y animales, incluyendo la electromiografía con aguja17 y tecnologías de imagen como la resonancia magnética, la tomografía computarizada y el ultrasonido18,19. Sin embargo, EIM demuestra beneficios distintos en comparación con estas tecnologías. Por ejemplo, la electromiografía registra solo las propiedades eléctricas activas de las membranas de miofibras y no las propiedades pasivas, y por lo tanto no puede proporcionar una verdadera evaluación de la composición o estructura muscular. En cierto sentido, los métodos de imagen están más estrechamente relacionados con EIM, ya que también proporcionan información sobre la estructura y composición del tejido. Pero, en cierto sentido, proporcionan demasiados datos, lo que requiere una segmentación detallada de la imagen y un análisis experto en lugar de simplemente proporcionar una salida cuantitativa. Además, dadas sus complejidades, las técnicas de imagen también se ven muy afectadas por las características específicas tanto del hardware como del software que se utilizan, lo que idealmente requiere el uso de sistemas idénticos para que se puedan comparar los conjuntos de datos. Por el contrario, el hecho de que EIM sea mucho más simple significa que se ve menos afectado por estos problemas técnicos y no requiere ninguna forma de procesamiento de imágenes o análisis experto.
El siguiente protocolo demuestra cómo realizar EIM de vivo en ratas y ratones, utilizando técnicas no invasivas (matriz de superficie) y mínimamente invasivas (matriz de agujas subdérmicas), así como EIM ex vivo en músculo recién extirpado.
Protocol
Representative Results
Discussion
Este artículo proporciona los métodos básicos para realizar EIM en roedores, tanto de vivo como ex vivo. Para adquirir mediciones confiables, es fundamental realizar una serie de pasos. Primero, uno necesita identificar adecuadamente el músculo de interés, ya que cada músculo tendrá diferentes respuestas a enfermedades, tratamiento y patología. Uno debe ser consciente de que los datos adquiridos en un músculo (por ejemplo, gastrocnemio) no proporcionarán la misma información que en otro músc…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por Charley’s Fund y NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
Referências
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

