Udførelse af in vivo og ex vivo elektrisk impedansmyografi hos gnavere
Summary
Denne artikel beskriver, hvordan man udfører de vivo (ved hjælp af overflade- og nåleelektrodearrays) og ex vivo (ved hjælp af en dielektrisk celle) elektrisk impedansmyografi på gnavergastrocnemiusmusklen. Det vil demonstrere teknikken hos både mus og rotter og detaljere de tilgængelige ændringer (dvs. overvægtige dyr, hvalpe).
Abstract
Elektrisk impedansmyografi (EIM) er en bekvem teknik, der kan bruges i prækliniske og kliniske undersøgelser til vurdering af muskelvævs sundhed og sygdom. EIM opnås ved at anvende en lavintensiv, retningsfokuseret, elektrisk strøm til en muskel af interesse over en frekvensrække (dvs. fra 1 kHz til 10 MHz) og registrere de resulterende spændinger. Fra disse opnås flere standardimpedanskomponenter, herunder reaktans, modstand og fase. Ved udførelse af ex vivo-målinger på udskåret muskel kan vævets iboende passive elektriske egenskaber, nemlig ledningsevnen og relativ permittivitet, også beregnes. EIM er blevet brugt i vid udstrækning hos dyr og mennesker til at diagnosticere og spore muskelforandringer i en række sygdomme, i forbindelse med simpel brug atrofi eller som et mål for terapeutisk intervention. Klinisk tilbyder EIM potentialet til at spore sygdomsprogression over tid og vurdere virkningen af terapeutiske interventioner, hvilket giver mulighed for at forkorte varigheden af kliniske forsøg og reducere kravene til stikprøvestørrelse. Fordi det kan udføres ikke-invasivt eller minimalt invasivt i levende dyremodeller såvel som mennesker, tilbyder EIM potentialet til at fungere som et nyt translationelt værktøj, der muliggør både præklinisk og klinisk udvikling. Denne artikel indeholder trinvise instruktioner om, hvordan EIM-målinger in vivo og ex vivo udføres på mus og rotter, herunder metoder til at tilpasse teknikkerne til specifikke forhold, f.eks. til brug hos hvalpe eller overvægtige dyr.
Introduction
Elektrisk impedansmyografi (EIM) giver en kraftfuld metode til vurdering af muskeltilstand, hvilket potentielt muliggør diagnosticering af neuromuskulære lidelser, sporing af sygdomsprogression og vurdering af respons på terapi 1,2,3. Det kan anvendes analogt på dyresygdomsmodeller og mennesker, hvilket giver mulighed for relativt problemfri oversættelse fra prækliniske til kliniske undersøgelser. EIM-målinger opnås let ved hjælp af fire lineært placerede elektroder, hvor de to ydre anvender en smertefri, svag elektrisk strøm over en række frekvenser (generelt mellem 1 kHz og ca. 2 MHz), og de to indre, der registrerer de resulterende spændinger1. Fra disse spændinger kan vævets impedansegenskaber opnås, herunder modstanden (R), et mål for, hvor vanskeligt det er for strøm at passere gennem vævet, og vævets reaktans (X) eller “ladning”, et mål relateret til vævets evne til at lagre ladning (kapacitans). Fra reaktansen og modstanden beregnes fasevinklen (θ) via følgende ligning: 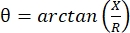 , hvilket giver et enkelt summativt impedansmål. Sådanne målinger kan opnås ved anvendelse af enhver multifrekvens bioimpedansanordning. Da myofibre i det væsentlige er lange cylindre, er muskelvæv også meget anisotropisk, med strøm, der flyder lettere langs fibre end på tværs af dem 4,5. Således udføres EIM ofte i to retninger: med arrayet placeret langs fibrene, således at strømmen løber parallelt med dem og over musklen, således at strømmen strømmer vinkelret på dem. Ved ex vivo-målinger, hvor et kendt vævsvolumen måles i en impedansmålecelle, kan musklens iboende elektriske egenskaber (dvs. ledningsevnen og den relative permittivitet) desuden udledes6.
, hvilket giver et enkelt summativt impedansmål. Sådanne målinger kan opnås ved anvendelse af enhver multifrekvens bioimpedansanordning. Da myofibre i det væsentlige er lange cylindre, er muskelvæv også meget anisotropisk, med strøm, der flyder lettere langs fibre end på tværs af dem 4,5. Således udføres EIM ofte i to retninger: med arrayet placeret langs fibrene, således at strømmen løber parallelt med dem og over musklen, således at strømmen strømmer vinkelret på dem. Ved ex vivo-målinger, hvor et kendt vævsvolumen måles i en impedansmålecelle, kan musklens iboende elektriske egenskaber (dvs. ledningsevnen og den relative permittivitet) desuden udledes6.
Udtrykket “neuromuskulære lidelser” definerer en bred vifte af primære og sekundære sygdomme, der fører til strukturel muskelændring og dysfunktion. Dette omfatter amyotrofisk lateral sklerose og forskellige former for muskeldystrofi samt enklere ændringer relateret til aldring (f.eks. Sarkopeni), brug af atrofi (f.eks. På grund af langvarig sengeleje eller mikrogravitet) eller endda skade7. Mens årsagerne er rigelige og kan stamme fra motorneuronen, nerverne, neuromuskulære kryds eller selve musklen, kan EIM bruges til at opdage tidlige ændringer i muskler på grund af mange af disse processer og til at spore progression eller respons på terapi. For eksempel har EIM hos patienter med Duchenne muskeldystrofi (DMD) vist sig at detektere sygdomsprogression og respons på kortikosteroider8. Nyligt arbejde har også vist, at EIM er følsom over for forskellige disusetilstande, herunder fraktioneret tyngdekraft9, som det ville blive oplevet på Månen eller Mars, og virkningerne af aldring10,11. Endelig bliver det ved at anvende prædiktive og maskinindlæringsalgoritmer på datasættet opnået med hver måling (multifrekvens og retningsafhængige data) muligt at udlede histologiske aspekter af vævet, herunder myofiberstørrelse 12,13, inflammatoriske ændringer og ødem14 og bindevæv og fedtindhold 15,16.
Flere andre ikke-invasive eller minimalt invasive metoder bruges også til at evaluere muskelsundhed hos mennesker og dyr, herunder nåleelektromyografi17 og billeddannelsesteknologier såsom magnetisk resonansbilleddannelse, computertomografi og ultralyd18,19. EIM viser imidlertid tydelige fordele sammenlignet med disse teknologier. For eksempel registrerer elektromyografi kun myofibermembranernes aktive elektriske egenskaber og ikke de passive egenskaber og kan derfor ikke give en sand vurdering af muskelsammensætning eller struktur. I en vis henseende er billeddannelsesmetoder tættere forbundet med EIM, da de også giver information om vævets struktur og sammensætning. Men i en vis forstand giver de for meget data, hvilket kræver detaljeret billedsegmentering og ekspertanalyse snarere end blot at give et kvantitativt output. På grund af deres kompleksitet påvirkes billeddannelsesteknikker også i høj grad af specifikationerne for både hardware og software, der anvendes, hvilket ideelt set kræver brug af identiske systemer, så datasæt kan sammenlignes. I modsætning hertil betyder det faktum, at EIM er meget enklere, at det er mindre påvirket af disse tekniske problemer og ikke kræver nogen form for billedbehandling eller ekspertanalyse.
Følgende protokol viser, hvordan man udfører de vivo EIM hos rotter og mus ved hjælp af både ikke-invasive (overfladearray) og minimalt invasive (subdermal nålearray) teknikker samt ex vivo EIM på frisk udskåret muskel.
Protocol
Representative Results
Discussion
Denne artikel indeholder de grundlæggende metoder til udførelse af EIM hos gnavere, både in vivo og ex vivo. For at opnå pålidelige målinger er det vigtigt at udføre en række trin. For det første skal man korrekt identificere muskelen af interesse, da hver muskel vil have forskellige reaktioner på sygdomme, behandling og patologi. Man skal være opmærksom på, at de data, der er erhvervet på en muskel (f.eks. Gastrocnemius), ikke giver de samme oplysninger som på en anden muskel (f.eks. Tib…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af Charley’s Fund og NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
Referências
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

