מיקרוסקופיית כוח אטומי לחקר התכונות הפיזיקליות של תאי אפידרמיס של שורשי ערבידופסיס חיים
Summary
פרוטוקול הכניסה למיקרוסקופיה של הכוח האטומי מציע את האפשרות לנתח את תפקיד התכונות הפיזיקליות של דופן התא של תא מסוים ברקמה או באיבר במהלך גדילה רגילה או מוגבלת (כלומר, תחת גירעון מים).
Abstract
כאן מתוארת שיטה לאפיון התכונות הפיזיקליות של דופן התא של תאי האפידרמיס של שורשי ערבידופסיס חיים באמצעות ננו-אינסטנציות באמצעות מיקרוסקופ כוח אטומי (AFM) בשילוב עם מיקרוסקופ פלואורסצנטי הפוך אופטי. השיטה מורכבת מהפעלת כוחות מבוקרים על הדגימה תוך מדידת העיוות שלה, ומאפשרת לכמת פרמטרים כגון מודולוס דופן התא של יאנג לכאורה ברזולוציות תת-תאיות. זה דורש אימוביליזציה מכנית זהירה של המדגם ובחירה נכונה של כניסות ועומקי כניסה. למרות שניתן להשתמש בו רק ברקמות חיצוניות, שיטה זו מאפשרת לאפיין שינויים מכניים בדפנות תאי הצמח במהלך ההתפתחות ומאפשרת קורלציה של שינויים מיקרוסקופיים אלה עם גדילה של איבר שלם.
Introduction
תאי הצמח מוקפים בדופן תא שהיא מבנה מורכב המורכב מרשתות אינטראקציה של פוליסכרידים, חלבונים, מטבוליטים ומים שעוביים משתנה מ-0.1 למספר מיקרומטר בהתאם לסוג התא ולשלב הגדילה 1,2. תכונות מכניות של דופן התא ממלאות תפקיד חיוני בצמיחת צמחים. ערכי קשיחות נמוכים של דופן התא הוצעו כתנאי מקדים לצמיחת התא ולהרחבת דופן התא, ויש ראיות הולכות וגוברות לכך שכל התאים חשים כוחות מכניים כדי לבצע את תפקידיהם. עם זאת, עדיין מתלבטים אם שינויים בתכונות הפיזיקליות של דופן התא קובעים את גורל התא 2,3,4. מאחר שתאי צמחים אינם זזים במהלך ההתפתחות, צורתו הסופית של איבר תלויה במרחק ובאיזה כיוון תא מתרחב. לפיכך, שורש ערבידופסיס הוא מודל טוב לחקר ההשפעה של התכונות הפיזיקליות של דופן התא בהרחבת התא מכיוון שסוגים שונים של התפשטות מתרחשים באזורים שונים של השורש. לדוגמה, התפשטות אניזוטרופית ניכרת באזור ההתארכות ובולטת במיוחד בתאי האפידרמיס5.
השיטה המתוארת כאן שימשה לאפיון התכונות הפיזיקליות של דופן התא של תאי האפידרמיס בקנה מידה ננומטרי של שורשי ערבידופסיס חיים באמצעות מיקרוסקופ כוח אטומי (AFM) בשילוב עם מיקרוסקופ פאזה פלואורסצנטית הפוכה6. לתיקון מקיף של טכניקת AFM, קרא 7,8,9.
פרוטוקול זה מתווה שיטה בסיסית להכנת דגימות ושיטה כללית למדידות גמישות מבוססות AFM של דפנות תאי צמחים.
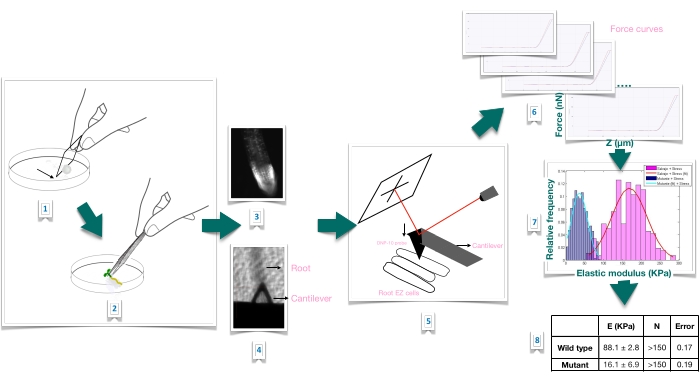
איור 1: סקירה סכמטית של ניסוי כניסת כוח בשורשי ערבידופסיס באמצעות מיקרוסקופיית כוח אטומי (AFM). התוכנית נותנת סקירה של השלבים של ניסוי Force-Indentation מהכנת המצע כדי לשתק את דגימת השורש בחוזקה (1-2), אישור כדאיות השורש באמצעות צביעת פרופידיום יודיד (3), מיקום קנטילבר על פני השטח של תא אפידרמיס מוארך של השורש הראשוני (4-5), מדידת עקומות כוח (6), ועיבוד עקומת כוח לחישוב המודולוס של יאנג הנראה (7-8). EZ: אזור התארכות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
מכניקת התאים ודפנות התאים הופכת רלוונטית יותר ויותר כדי לקבל תובנה לגבי האופן שבו מכניקה משפיעה על תהליכי גדילה. כאשר כוחות פיזיקליים מתפשטים על פני מרחקים ניכרים ברקמות מוצקות, חקר השינויים בתכונות הפיזיקליות של דופן התא וכיצד הם חשים, מבוקרים, מכוונים ומשפיעים על צמיחת הצמח הופכים לתחו…
Declarações
The authors have nothing to disclose.
Acknowledgements
מחקר זה מומן על ידי CSIC I+D 2018, מענק מס ’95 (מריאנה סוטלו סילביירה).; CSIC גרופוס (עומר בורסאני) ו-PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
Referências
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

