Atomkraftsmikroskopi för att studera de fysikaliska egenskaperna hos epidermala celler av levande Arabidopsis-rötter
Summary
Atomkraftsmikroskopiets indragningsprotokoll erbjuder möjligheten att dissekera rollen för de fysikaliska egenskaperna hos cellväggen hos en viss cell i en vävnad eller ett organ under normal eller begränsad tillväxt (dvs. under vattenunderskott).
Abstract
En metod beskrivs här för att karakterisera de fysikaliska egenskaperna hos cellväggen hos epidermala celler från levande Arabidopsis-rötter genom nanoindragningar med ett atomkraftmikroskop (AFM) i kombination med ett optiskt inverterat fluorescensmikroskop. Metoden består i att applicera kontrollerade krafter på provet samtidigt som man mäter dess deformation, vilket möjliggör kvantifiering av parametrar såsom den uppenbara Youngs modul av cellväggar vid subcellulära upplösningar. Det kräver en noggrann mekanisk immobilisering av provet och korrekt urval av indenters och indragningsdjup. Även om den endast kan användas i yttre vävnader, tillåter denna metod att karakterisera mekaniska förändringar i växtcellväggar under utveckling och möjliggör korrelationen mellan dessa mikroskopiska förändringar och tillväxten av ett helt organ.
Introduction
Växtceller är omgivna av en cellvägg som är en komplex struktur som består av interagerande nätverk av polysackarider, proteiner, metaboliter och vatten som varierar i tjocklek från 0,1 till flera μm beroende på celltyp och tillväxtfas 1,2. Cellväggsmekaniska egenskaper spelar en viktig roll i växternas tillväxt. Låga styvhetsvärden för cellväggen har föreslagits som en förutsättning för celltillväxt och cellväggsutvidgning, och det finns ökande bevis för att alla celler känner av mekaniska krafter för att utföra sina funktioner. Det diskuteras dock fortfarande om förändringar i cellväggens fysikaliska egenskaper avgör cellens öde 2,3,4. Eftersom växtceller inte rör sig under utvecklingen beror den slutliga formen på ett organ på hur långt och i vilken riktning en cell expanderar. Således är Arabidopsisrot en bra modell för att studera effekterna av cellväggsfysikaliska egenskaper vid cellutvidgning eftersom olika typer av expansion förekommer i olika regioner av roten. Till exempel är anisotrop expansion uppenbar i förlängningszonen och särskilt märkbart i epidermala celler5.
Metoden som beskrivs här användes för att karakterisera de fysikaliska egenskaperna hos cellväggen hos epidermala celler på nanoskalan hos levande Arabidopsis-rötter med hjälp av ett atomkraftmikroskop (AFM) i kombination med ett inverterat fluorescensfasmikroskop6. För en omfattande revidering av AFM-tekniken, läs 7,8,9.
Detta protokoll beskriver en grundläggande provberedningsmetod och en allmän metod för AFM-baserade elasticitetsmätningar av växtcellväggar.
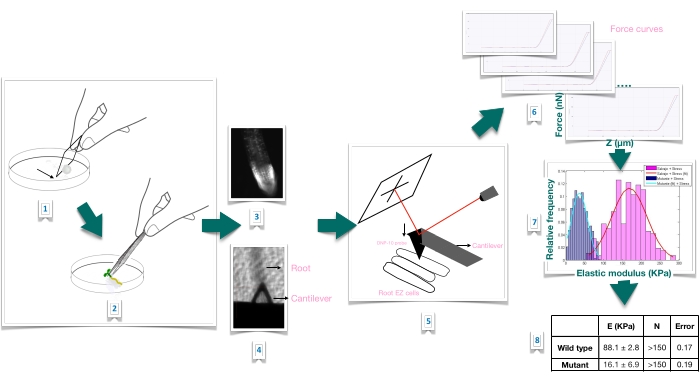
Figur 1: Schematisk översikt över kraftindragningsexperiment i Arabidopsis-rötter med hjälp av atomkraftmikroskopi (AFM). Schemat ger en översikt över stegen i ett Force-Indentation-experiment från beredningen av substratet för att immobilisera rotprovet ordentligt (1-2), rotviabilitetsbekräftelse genom propidiumjodidfärgning (3), cantileverpositionering på ytan av en långsträckt epidermal cell i den primära roten (4-5), kraftkurvmätning (6) och kraftkurvbearbetning för att beräkna den uppenbara Youngs modul (7-8). EZ: förlängningszon. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Cell- och cellväggsmekanik blir alltmer relevant för att få insikt i hur mekanik påverkar tillväxtprocesser. När fysiska krafter sprider sig över betydande avstånd i fasta vävnader blir studien av förändringar i cellväggens fysikaliska egenskaper och hur de avkänns, kontrolleras, ställs in och påverkar växtens tillväxt ett viktigt studieområde 2,3,8.
En metod presenteras här för at…
Declarações
The authors have nothing to disclose.
Acknowledgements
Denna forskning finansierades av CSIC I + D 2018, bidrag nr 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) och PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
Referências
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

