Microscopia de Força Atômica para Estudo das Propriedades Físicas de Células Epidérmicas de Raízes Vivas de Arabidopsis
Summary
O protocolo de indentação por microscopia de força atômica oferece a possibilidade de dissecar o papel das propriedades físicas da parede celular de uma determinada célula de um tecido ou órgão durante o crescimento normal ou restrito (ou seja, sob déficit hídrico).
Abstract
Um método é descrito aqui para caracterizar as propriedades físicas da parede celular de células epidérmicas de raízes vivas de Arabidopsis através de nanoindentações com um microscópio de força atômica (AFM) acoplado a um microscópio óptico de fluorescência invertida. O método consiste em aplicar forças controladas à amostra enquanto mede sua deformação, permitindo quantificar parâmetros como o módulo aparente de Young das paredes celulares em resoluções subcelulares. Requer uma cuidadosa imobilização mecânica da amostra e seleção correta de indenters e profundidades de recuo. Embora possa ser usado apenas em tecidos externos, este método permite caracterizar mudanças mecânicas nas paredes celulares das plantas durante o desenvolvimento e permite a correlação dessas alterações microscópicas com o crescimento de um órgão inteiro.
Introduction
As células vegetais são circundadas por uma parede celular que é uma estrutura complexa composta por redes interativas de polissacarídeos, proteínas, metabólitos e água que varia em espessura de 0,1 a vários μm, dependendo do tipo celular e da fase de crescimento 1,2. As propriedades mecânicas da parede celular desempenham um papel essencial no crescimento das plantas. Baixos valores de rigidez da parede celular têm sido propostos como uma pré-condição para o crescimento celular e a expansão da parede celular, e há evidências crescentes de que todas as células sentem forças mecânicas para desempenhar suas funções. No entanto, ainda é debatido se as alterações nas propriedades físicas da parede celular determinam o destino celular 2,3,4. Como as células vegetais não se movem durante o desenvolvimento, a forma final de um órgão depende de quão longe e em que direção uma célula se expande. Assim, a raiz de Arabidopsis é um bom modelo para estudar o impacto das propriedades físicas da parede celular na expansão celular, pois diferentes tipos de expansão ocorrem em diferentes regiões da raiz. Por exemplo, a expansão anisotrópica é evidente na zona de alongamento e, particularmente, nas células epidérmicas5.
O método aqui descrito foi utilizado para caracterizar as propriedades físicas da parede celular de células epidérmicas em nanoescala de raízes vivas de Arabidopsis utilizando um Microscópio de Força Atômica (AFM) acoplado a um microscópio de fase de fluorescência invertida6. Para uma extensa revisão da técnica AFM, leia 7,8,9.
Este protocolo descreve um método básico de preparação de amostras e um método geral para medições de elasticidade baseadas em AFM de paredes celulares de plantas.
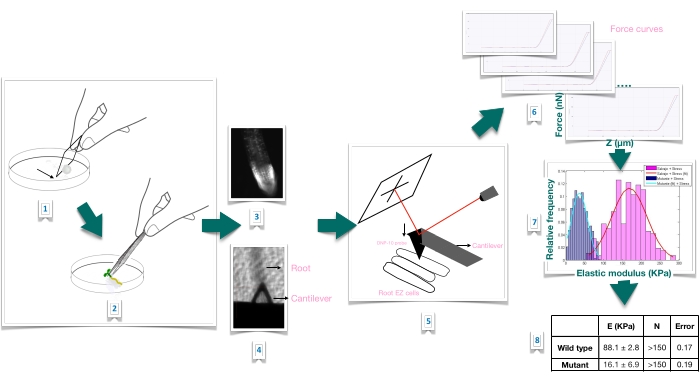
Figura 1: Visão geral esquemática do experimento de indentação de força em raízes de Arabidopsis usando microscopia de força atômica (AFM). O esquema fornece uma visão geral das etapas de um experimento de Força-Indentação desde a preparação do substrato para imobilizar a amostra radicular firmemente (1-2), confirmação da viabilidade radicular através da coloração de iodeto de propídio (3), posicionamento do cantilever na superfície de uma célula epidérmica alongada da raiz primária (4-5), medição de curvas de força (6) e processamento de curva de força para calcular o módulo aparente de Young (7-8). EZ: zona de alongamento. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A mecânica celular e da parede celular está se tornando cada vez mais relevante para obter informações sobre como a mecânica afeta os processos de crescimento. À medida que as forças físicas se propagam por distâncias consideráveis nos tecidos sólidos, o estudo das mudanças nas propriedades físicas da parede celular e como elas são sentidas, controladas, ajustadas e impactam o crescimento da planta estão se tornando um importante campo de estudo 2,3,8</s…
Declarações
The authors have nothing to disclose.
Acknowledgements
Esta investigação foi financiada pelo CSIC I+D 2018, bolsa n.º 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) e PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
Referências
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

