Preparação e Análise Morfológica das Culturas celulares da crista neural do pintinho
Summary
Este protocolo versátil descreve o isolamento das células de crista neural pré-cardíaca (NCCs) através da excisão de dobras neurais cranianas de embriões de filhotes. Após o revestimento e a incubação, as DCNT migratórias emergem das explicações da dobra neural, permitindo a avaliação da morfologia celular e da migração em um ambiente 2D simplificado.
Abstract
Durante o desenvolvimento de vertebrados, as células da crista neural (NCCs) migram extensivamente e se diferenciam em vários tipos celulares que contribuem para estruturas como o esqueleto craniofacial e o sistema nervoso periférico. Embora seja fundamental compreender a migração do NCC no contexto de um embrião 3D, isolar células migratórias na cultura 2D facilita a visualização e a caracterização funcional, complementando estudos embrionários. O presente protocolo demonstra um método para isolar as dobras neurais cranianas de filhotes para gerar culturas primárias de NCC. NCCs migratórios emergem de explanações de dobra neural banhadas em um substrato revestido de fibronectina. Isso resulta em populações dispersas e aderentes da NCC que podem ser avaliadas por coloração e análises morfológicas quantitativas. Essa abordagem de cultura simplificada é altamente adaptável e pode ser combinada com outras técnicas. Por exemplo, a emigração ncc e comportamentos migratórios podem ser avaliados por imagens de lapso de tempo ou funcionalmente consultados por incluir inibidores ou manipulações experimentais da expressão genética (por exemplo, DNA, morfolino ou eletroporação CRISPR). Devido à sua versatilidade, este método fornece um poderoso sistema para investigar o desenvolvimento craniano do NCC.
Introduction
As células da crista neural (NCCs) são uma população celular transitória em embriões vertebrados. Os NCCs são especificados nas bordas da placa neural e passam por uma transição epitelial-mesenquimal (EMT) para migrar do tubo neural dorsal1. Após o EMT, os NCCs se dispersam extensivamente por todo o embrião, finalmente diferenciando e contribuindo para várias estruturas, incluindo o esqueleto craniofacial, o trato de saída do coração e a maioria do sistema nervoso periférico2. Mudanças na polaridade celular, no citoesqueleto e nas propriedades de adesão subjacentes a essa mudança de uma pré-conferência para uma população celular migratória3. Estudar o NCC EMT e a migração fornece insights sobre mecanismos fundamentais da motilidade celular e informa os esforços para prevenir e tratar defeitos congênitos e metástase do câncer.
Embora a análise in vivo seja vital para a compreensão dos processos de desenvolvimento do NCC em um contexto embrionário, os métodos in vitro oferecem acessibilidade visual e física que facilitam caminhos experimentais adicionais. Em um ambiente 2D simplificado, pode-se avaliar morfologia NCC, estruturas citoesqueletal e distância migrada. Além disso, podem ser analisados os efeitos da perturbação genética ou solúvel dos fatores em comportamentos migratórios das NCCs motile. Além disso, podem ser coletadas, coletadas e utilizadas NCCs pré-escolares isolados ou migratórias para metodologias de alto rendimento para estudar a regulação do desenvolvimento de DCNT através de perfis proteômicos, transcriômicos e epigenômicos 7,11. Enquanto os métodos estão disponíveis para a preparação de NCCs cranianas de vários organismos modelo de desenvolvimento 12,13,14, este artigo demonstra a mecânica da abordagem para aqueles que primeiro aprendem a cultivar ncc cranial a partir de embriões de filhotes.
O protocolo atual descreve uma técnica versátil para o preparo de culturas de NCC cranianos filhotes (Figura 1). Como os NCCs migram prontamente de dobras neurais explantadas para um substrato cultural, os NCCs de pintinhos naturalmente se segregam do tecido embrionário, e as culturas primárias são facilmente geradas. À medida que as NCCs de cérebro médio migram em massa a partir das dobras neurais cranianas (em contraste com a delaminação prolongada, célula por célula no tronco15), essas culturas consistem principalmente de células de crista neural craniana migratória, com excisão inicial de dobra neural fornecendo um método de coleta para DCNT pré-proporcionatórias. Um método básico para dissecar e cultivo de dobras neurais cranianas de filhotes é detalhado, e sugestões para diferentes aplicações e variações sobre este método são oferecidas.
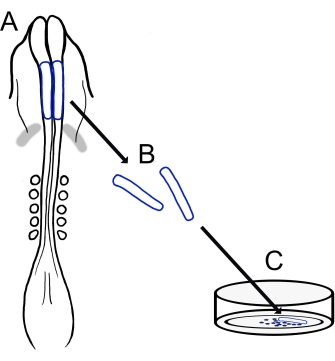
Figura 1: A visão geral esquemática do protocolo de cultura da dobra neural do filhote. (A,B) As dobras neurais cranianas (delineadas em azul) são extirpadas de um embrião de filhote com cinco somites (mostrados na visão dorsal em A). Bandas cinzentas, crescente cardíaco. (C) Quando banhadas em fibronectina, as células da crista neural migratória emergem das dobras neurais e se dispersam no substrato. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A técnica descrita aqui fornece um método adaptável de isolar as dobras neurais de filhotes e emplacando-as para criar culturas de NCCs cranianas migratórias. Essas culturas fornecem condições 2D simplificadas para fácil análise da migração e morfologia do NCC que podem complementar mais tecnicamente desafiadores nos métodos de imagem ovo 24,25,26. Embora este método in vitro seja relativamente simp…
Declarações
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Corinne A. Fairchild e Katie L. Vermillion, que participaram do desenvolvimento da nossa versão do protocolo de cultura de dobra neural craniana.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
Referências
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Biologia do Desenvolvimento. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Biologia do Desenvolvimento. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Biologia do Desenvolvimento. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Biologia do Desenvolvimento. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

